北京時間3月4日凌晨, 國際學(xué)術(shù)期刊《自然》以Research Article形式在線發(fā)表了上海交通大學(xué)醫(yī)學(xué)院上海市免疫學(xué)研究所蘇冰教授課題組的研究工作"MAP3K2-regulated intestinal stromal cells define a distinct stem cell niche”。該研究首次發(fā)現(xiàn)腸道干細胞底部存在一類被稱為MRISC的新型腸道間質(zhì)細胞(圖1)。該研究結(jié)合單細胞測序、ATAC測序、報告基因小鼠、體外腸道類器官共培養(yǎng)體系以及腸道間質(zhì)細胞原位注射等技術(shù),系統(tǒng)揭示了MRISC細胞在腸道炎癥和損傷過程中通過特異調(diào)控腸道干細胞微環(huán)境的Rspo1-WNT信號參與腸道上皮組織損傷修復(fù)的作用和機理,為腸道修復(fù)和再生及疾病臨床治療研究提供了新思路。
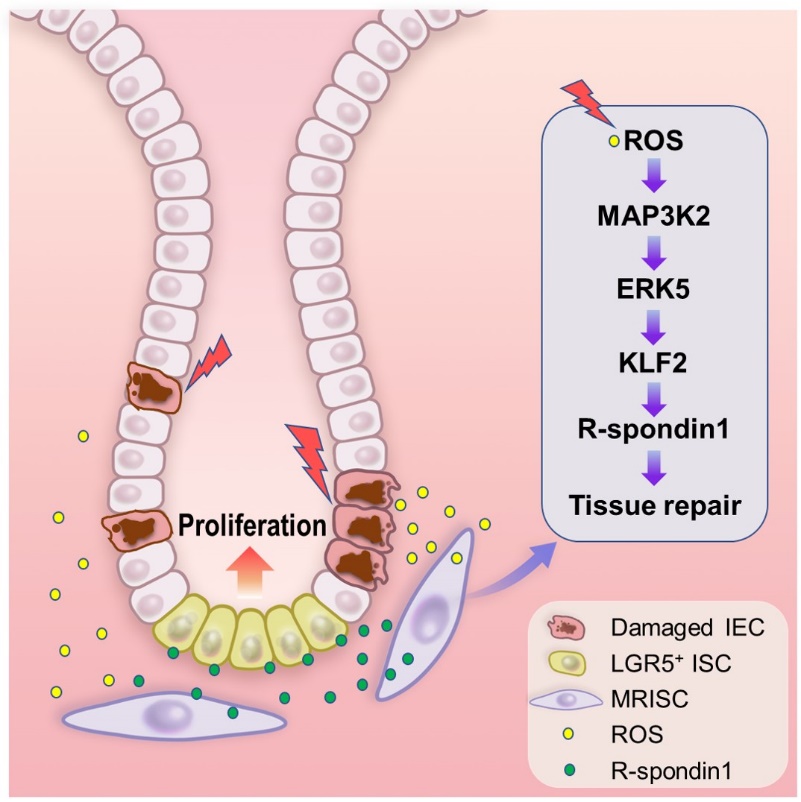
圖1. Working model腸道干細胞底部的MRISC腸道間質(zhì)細胞通過感受炎癥損傷誘導(dǎo)的ROS信號,激活MAP3K2-ERK5-KLF2信號通路,上調(diào)R-spondin1表達,從而提高腸道干細胞的Wnt信號,促進其增殖加強其修復(fù)腸道上皮損傷的功能。

原文鏈接:https://dx.doi.org/10.1038/s41586-021-03283-y
炎癥和損傷通常能迅速激發(fā)腸道干細胞增殖促進組織修復(fù)再生。腸道間質(zhì)細胞是腸道微環(huán)境組分中的重要成員,在FGF、TGF-β、Hedgehog與PDGF等信號調(diào)控下腸道間質(zhì)細胞可分化為多種復(fù)雜群體,它們通過與淋巴細胞、髓系細胞、上皮細胞、和神經(jīng)細胞的相互作用,協(xié)同調(diào)控腸道穩(wěn)態(tài)以及上皮干細胞的功能。借助譜系示蹤技術(shù),腸道間質(zhì)細胞的功能異質(zhì)性正在逐步得到闡明:不同的腸道間質(zhì)細胞群體通過不同生長因子與細胞因子的分泌可有效調(diào)節(jié)腸道穩(wěn)態(tài)與上皮結(jié)構(gòu)完整性。然而,這些新發(fā)現(xiàn)的腸道間質(zhì)細胞群體在腸道穩(wěn)態(tài)維持與疾病條件下,如何精細調(diào)控腸道功能至今仍然不清楚。
腸道間質(zhì)細胞長期以來被認為是一類相對簡單缺乏異質(zhì)性的功能細胞。它們都表達CD140a、Col1a2、Vimentin等少數(shù)幾個標(biāo)志物,目前仍然缺乏精細研究其組織空間分布和亞群的工具。近年來單細胞測序技術(shù)快速發(fā)展,揭示了腸道間質(zhì)細胞是一大類認知較少、異常復(fù)雜且具高度異質(zhì)性的間質(zhì)細胞(Cell,2018)。Foxl1+特洛細胞(Nature,2018)及CD81+滋養(yǎng)細胞(Cell Stem Cell,2020)的發(fā)現(xiàn),提示腸道可能存在多種分化不同且功能特異的腸道間質(zhì)細胞亞群。目前領(lǐng)域里對不同腸道間質(zhì)細胞亞群的特征、空間分布、它們在組織損傷修復(fù)中的潛在功能、以及調(diào)節(jié)的細胞和分子機制仍知之甚少。因此對新型腸道間質(zhì)細胞亞群的身份鑒定,上游刺激信號的發(fā)現(xiàn),以及中下游轉(zhuǎn)錄和表觀遺傳調(diào)控通路的闡明已成為間質(zhì)細胞領(lǐng)域最基礎(chǔ)和重要的科學(xué)問題。腸道上皮發(fā)育分化依賴于腸道微環(huán)境中的Wnt-BMP對沖信號的濃度梯度,但Wnt激活劑R-spondins梯度形成的調(diào)控機制仍然不清楚。盡管已知腸道間質(zhì)細胞是R-spondins的主要來源,但腸道“干細胞巢”(Stem Cell Niche)中R-spondins的細胞來源仍有諸多爭議。同時,R-spondin1蛋白的轉(zhuǎn)錄、翻譯以及釋放的調(diào)控機理也不明了。
蘇冰教授課題組的該項研究首先發(fā)現(xiàn)進化保守的Thr/Ser蛋白激酶MAP3K2對DSS誘導(dǎo)的小鼠腸炎能通過維持損傷腸道中Lgr5+干細胞的數(shù)量和功能起到關(guān)鍵的保護作用。MAP3K2是一個多器官組成性表達的絲/蘇氨酸蛋白激酶。在分子機制上研究人員發(fā)現(xiàn)Map3k2通過響應(yīng)DSS誘導(dǎo)的損傷信號上調(diào)R-spondin1的表達,介導(dǎo)MAPK信號與Wnt信號之間的互作;并確認腸道間質(zhì)細胞是腸道炎癥損傷信號上調(diào)R-spondin1表達的關(guān)鍵細胞。為了精確確定受MAP3K2調(diào)控的腸道間質(zhì)細胞的特征和功能,研究人員利用單細胞測序技術(shù)發(fā)現(xiàn)并分離得到一群帶有CD90+CD81+CD34+CD138-特征的腸道間質(zhì)細胞,并命名為MRISC。通過腸道類器官共培養(yǎng)以及腸道原位細胞注射實驗,課題組成功證明了MRISC具有對腸道干細胞特異的調(diào)節(jié)功能。并通過構(gòu)建全新的Rspo1-tdTomato報告基因小鼠,揭示MRISC定位于腸道“干細胞巢”的下方(圖2)。
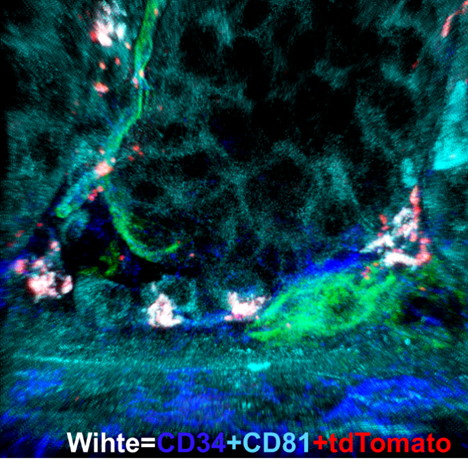
圖2. MRISC位于腸道干細胞Niche底部圖片是Rspo1-tdTomato小鼠結(jié)腸通過免疫熒光染色的方法顯示MRISC(CD34+CD81+tdTomato+)(白色)位于腸道隱窩干細胞底部。
為進一步研究MAP3K2特異調(diào)控新型腸道間質(zhì)細胞MRISC中R-spondin1表達的分子機制并探索其表觀遺傳的特征,研究人員獲取了不同腸道間質(zhì)細胞的ATAC-Seq數(shù)據(jù),揭示MRISC有著與其他間質(zhì)細胞非常不同的表觀遺傳調(diào)控特征(圖3),并發(fā)現(xiàn)MRISC的核心轉(zhuǎn)錄調(diào)控因子KLF2直接受MAP3K2信號調(diào)控。后續(xù)的體外實驗進一步發(fā)現(xiàn)了“活性氧(ROS)-MAP3K2-ERK5-KLF2”這一全新的誘導(dǎo)R-spondin1產(chǎn)生分子通路。通過同人腸道單細胞測序數(shù)據(jù)的比較分析,研究人員也找到了與小鼠MRISC對應(yīng)的人的MRISC細胞,并猜測其同樣可能參與調(diào)控腸道炎癥。
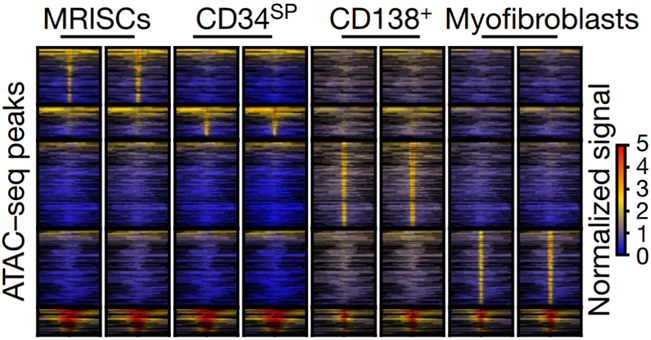
圖3. MRISC具有獨特的表觀遺傳特征圖片顯示小鼠結(jié)腸MRISC,CD34SP,CD138+,Myofibroblast間質(zhì)細胞ATAC-seq的熱圖結(jié)果,顯示同其它腸道間質(zhì)細胞比較MRISC具有獨特的染色體開放區(qū)域。
本文借MRISC的發(fā)現(xiàn)對以上皮干細胞微環(huán)境為靶點的炎癥性腸病治療方案具有重要的指導(dǎo)意義,同時新建立的間質(zhì)細胞示蹤模型也將極大促進腸道微環(huán)境研究領(lǐng)域的發(fā)展。但更為重要的是,通過對MRISC以及其它腸道間質(zhì)細胞亞群的鑒定,讓我們意識到間質(zhì)細胞可能就像CD4+T淋巴細胞一樣,包含諸如參與I、II、III型免疫反應(yīng)的效應(yīng)T細胞、調(diào)節(jié)性T細胞以及濾泡輔助性T細胞等多個輔助性CD4+T細胞亞群,這些CD4+T細胞亞群的發(fā)現(xiàn)推動了T細胞領(lǐng)域近四十年的深入研究。因此,MRISC以及其它主要間質(zhì)細胞亞群標(biāo)記系統(tǒng)的建立必將極大推動間質(zhì)細胞在免疫、神經(jīng)、腫瘤、代謝、衰老等生命科學(xué)重要過程中功能的闡釋;而人體內(nèi)相對應(yīng)的間質(zhì)細胞主要亞群的發(fā)現(xiàn)和鑒定將同樣推動其在人類疾病如腸道腫瘤、食物過敏等炎癥誘導(dǎo)疾病中作用的解析。
這項研究是蘇冰教授團隊通力協(xié)作的成果,也是蘇冰教授離開耶魯大學(xué)回國后加入上海交通大學(xué)醫(yī)學(xué)院開展的第一個課題。課題組伍寧波博士和孫宏翔博士是該論文的共同第一作者。伍寧波博士2012年開始啟動本課題的研究,受實驗室建設(shè)初期實驗條件限制,課題組用了近兩年的時間建立并逐步積累實驗所需基本條件,得到第一個表型。之后在伍寧波博士和孫宏翔博士的精誠團結(jié)緊密合作和課題組的支持下,經(jīng)過漫長的摸索最終聚焦到腸道間質(zhì)細胞MRISC。



伍寧波 博士 蘇冰 教授 孫宏翔 博士
文章通訊作者蘇冰教授是上海交通大學(xué)王寬誠講席教授,上海市免疫學(xué)研究所所長,上海交通大學(xué)醫(yī)學(xué)院免疫與微生物系系主任。蘇冰教授同時兼任上海交通大學(xué)醫(yī)學(xué)院-耶魯大學(xué)免疫代謝研究院主任。蘇冰教授長期致力于MAPK和SIN1/mTOR調(diào)控的細胞信號轉(zhuǎn)導(dǎo)研究,取得了一系列突破性科學(xué)發(fā)現(xiàn)和成果。相關(guān)工作以通訊作者相繼發(fā)表于國際頂尖雜志包括Cell,Nature Genetics,Nature,Nature Immunology,Immunity,EMBO J,Blood,Mol Cell等雜志。近年來蘇冰教授課題組聚焦腸道黏膜免疫和炎癥相關(guān)疾病的基礎(chǔ)研究,并與瑞金醫(yī)院、仁濟醫(yī)院等臨床科室合作開展臨床轉(zhuǎn)化研究。
該項研究還得到了來自包括新加坡免疫學(xué)聯(lián)網(wǎng)的Florent Ginhoux教授(上海市免疫學(xué)研究所客座教授)、Lai Guan Ng教授、Melissa Ng博士、中國科學(xué)院分子細胞科學(xué)卓越創(chuàng)新中心(生物化學(xué)與細胞生物學(xué)研究所)周斌研究員、何靈娟博士、 曾藝研究員、耶魯大學(xué)Richard Flavell教授(兼任上海交通大學(xué)醫(yī)學(xué)院-耶魯大學(xué)免疫代謝研究院教授)、Manolis Roulis博士、瑞金醫(yī)院消化科鄒多武主任和博士生張堯以及上海市免疫學(xué)研究所的劉智多、陳磊、葉幼瓊及李華兵研究員、上海交通大學(xué)醫(yī)學(xué)院基礎(chǔ)醫(yī)學(xué)院程金科教授等在內(nèi)的多方合作與鼎力支持。課題組的多位研究生尤其是趙曉赟和譚劍美同學(xué)為本研究做出了重要貢獻。文章作者也借此機會感謝國家自然科學(xué)基金委(項目3201101152、91942311、和31930035)、上海市科委(項目20410714000)和癌基因與相關(guān)基因國家重點實驗室的支持,感謝上海交通大學(xué)醫(yī)學(xué)院上海市免疫學(xué)研究所流式平臺、單細胞測序平臺、顯微成像平臺、基因修飾動物平臺對此研究的鼎力支持,最后感謝蘇冰教授課題組的全體成員對本研究的支持。
蘇冰教授及研究團隊
目前蘇冰教授團隊正基于此項研究建立的系統(tǒng)和方法開展進一步的分子機制與臨床轉(zhuǎn)化研究,博士后加盟或洽談?wù)n題合作,歡迎直接發(fā)送郵件聯(lián)系:[email protected]。
蘇冰教授實驗室簡介:
DetailMemberInfo.php?pid=6&cid=22&num=22&id=10
撰稿:伍寧波、孫宏翔
審核:方麗娟、蘇 冰
 滬公網(wǎng)安備 31009102000053號 滬ICP備18007527號-1 郵箱:[email protected]
滬公網(wǎng)安備 31009102000053號 滬ICP備18007527號-1 郵箱:[email protected] 滬公網(wǎng)安備 31009102000053號 滬ICP備18007527號-1 郵箱:[email protected]
滬公網(wǎng)安備 31009102000053號 滬ICP備18007527號-1 郵箱:[email protected]