2020年8月6日,,上海交通大學(xué)醫(yī)學(xué)院/上海市免疫學(xué)研究所梁啟明課題組聯(lián)合美國南加州大學(xué)醫(yī)學(xué)院趙振課題組在
Cell Stem Cell雜志在線發(fā)表了題為
The Zika Virus Capsid Disrupts Corticogenesis by Suppressing Dicer Activity and miRNA Biogenesis的文章。該研究表明,,寨卡病毒C蛋白(Capsid protein)能夠和Dicer酶相互作用從而抑制Dicer的miRNA的加工活性,,尤其是抑制了一些神經(jīng)發(fā)育相關(guān)的miRNA的產(chǎn)生,,最終抑制神經(jīng)發(fā)生并導(dǎo)致小頭畸形。


寨卡病毒是一種屬于黃病毒屬的蟲媒傳播病毒,。早在1947年,,就已經(jīng)從一只來自非洲烏干達的寨卡森林中的有發(fā)熱癥狀的恒河猴體內(nèi)被首次分離得到,因此得名“寨卡”。在過去的70多年中極少有與之相關(guān)的研究被發(fā)表,,原因在于它只會引起發(fā)熱,、關(guān)節(jié)痛、結(jié)膜炎,、皮疹等輕微癥狀,,且癥狀很快消失。然而在2015-2016年,,寨卡病毒突然在巴西,、美國、東南亞地區(qū)爆發(fā),,很快擴散至全球61個國家和地區(qū),,并與胎兒流產(chǎn),新生兒小頭畸形,、格蘭-巴雷綜合征等病例的快速增加密切相關(guān),。2016年初,世界衛(wèi)生組織將寨卡病毒列為全球公共衛(wèi)生緊急事件,,從而極大加快了全球?qū)φú《狙芯康牟椒?,在短時間內(nèi)就建立了多種小鼠和非人靈長類動物的寨卡感染疾病模型,并且被應(yīng)用到寨卡病毒的診斷,,治療以及相關(guān)疫苗的臨床前評價中,。然而,到目前為止,,寨卡病毒導(dǎo)致新生兒小頭病的致病機理仍不清楚,,與之相關(guān)的分子機制,尤其是感染神經(jīng)系統(tǒng)的機制的研究非常有限,,嚴重影響了抗病毒靶向藥物的研發(fā),。
RNA干擾(RNAi)是由小分子雙鏈RNA引發(fā)的轉(zhuǎn)錄后基因沉默過程,正常細胞自身的RNA干擾調(diào)控對于細胞分化,、發(fā)育等都發(fā)揮著非常重要的作用,。細胞核內(nèi)轉(zhuǎn)錄產(chǎn)生的初始miRNA(pri-miRNA)被Drosha加工成miRNA前體(pre-miRNA)后,由轉(zhuǎn)運蛋白Exportin-5轉(zhuǎn)運進入細胞質(zhì),。胞質(zhì)中的核酸內(nèi)切酶 Dicer會將這些miRNA前體切割成多個具有特定長度(約21~23 bp)和結(jié)構(gòu)的小片段雙鏈RNA,即成熟的miRNA,。miRNA一條鏈與含有Ago2的蛋白復(fù)合物結(jié)合形成RNA誘導(dǎo)的沉默復(fù)合物(RNA-induced silencing complex,,RISC)。RISC和與miRNA具有同源區(qū)的mRNA序列進行特異性結(jié)合,,在結(jié)合部位切割mRNA,,引起轉(zhuǎn)錄后調(diào)控(圖1)。最近有研究表明,,神經(jīng)細胞中Dicer酶缺陷會引起神經(jīng)發(fā)育的退化.
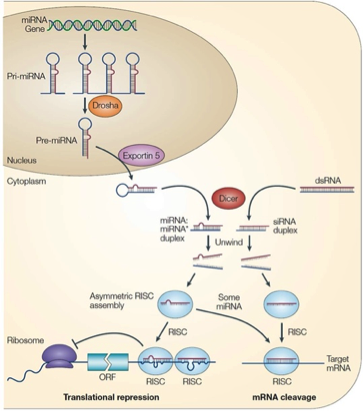
圖1:RNA干擾系統(tǒng)的實現(xiàn)過程
在本研究中,,研究人員通過繪制寨卡病毒蛋白與宿主神經(jīng)干細胞蛋白質(zhì)組相互作用網(wǎng)絡(luò)(圖2),,篩選出寨卡病毒C蛋白可以與核酸內(nèi)切酶 Dicer特異性的相互作用,而其他一些典型的黃病毒屬病毒如登革熱病毒(DENV),、日本腦炎病毒(JEV),、西尼羅病毒(WNV)等的C蛋白都不具備這種相互作用特征,這極有可能是寨卡病毒區(qū)別于其他黃病毒屬病毒,,能引起神經(jīng)退行性疾病的原因之一,。這種特異的相互作用能夠抑制Dicer對miRNA的加工活性,使成熟miRNA,,尤其是一些與神經(jīng)發(fā)育相關(guān)的miRNA(let-7a,、miR-9、miR-17等)的合成受阻,。
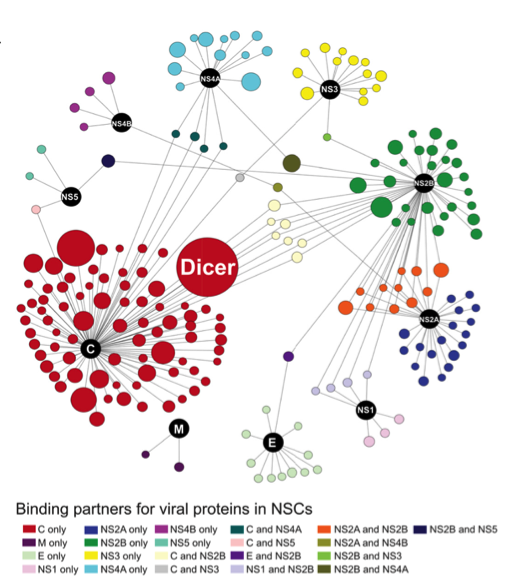
圖2:寨卡病毒蛋白與宿主神經(jīng)干細胞蛋白質(zhì)組相互作用網(wǎng)絡(luò)
研究人員通過對寨卡病毒和其他典型黃病毒屬病毒C蛋白氨基酸序列比對,,發(fā)現(xiàn)其第41位的單點氨基酸突變(H41R)使C蛋白喪失了與Dicer的互作,并且不再抑制Dicer的加工切割活性,。接著通過病毒反向遺傳學(xué)產(chǎn)生出寨卡野生型以及C蛋白具有H41R突變的活病毒,,通過子宮微注射的方式將二者感染進胚胎期13.5天(E13.5)的胎鼠大腦(圖3),并在E18.5時通過對胎鼠大腦大小的測量以及各腦層的染色發(fā)現(xiàn),,較于突變病毒,,野生型病毒會導(dǎo)致更小的胎鼠大腦以及更薄的大腦皮層,說明寨卡病毒C蛋白對Dicer的抑制確實能夠引起神經(jīng)發(fā)育缺陷,。此外,,為了證實在活體水平上寨卡病毒C蛋白自身是否足以引起神經(jīng)發(fā)育缺陷,研究人員利用AAV基因傳遞系統(tǒng),,將寨卡病毒C蛋白及其突變分別以AAV病毒的形式微注射入胎鼠大腦,,發(fā)現(xiàn)寨卡病毒C蛋白自身足以引起神經(jīng)發(fā)育缺陷。
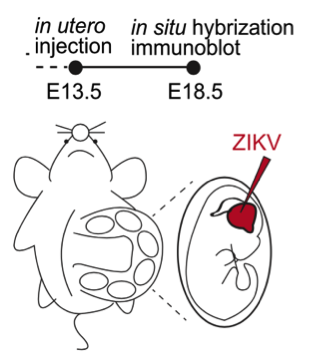
圖3:胎鼠大腦微注射示意圖
綜上所述:寨卡病毒C蛋白能夠和Dicer酶相互作用從而抑制Dicer的miRNA的加工活性,,尤其是抑制了一些神經(jīng)發(fā)育相關(guān)的miRNA的產(chǎn)生,,最終抑制神經(jīng)發(fā)生并導(dǎo)致小頭畸形(圖4)。該研究為了解寨卡病毒的獨特致病機制提供了一部分理論依據(jù),。
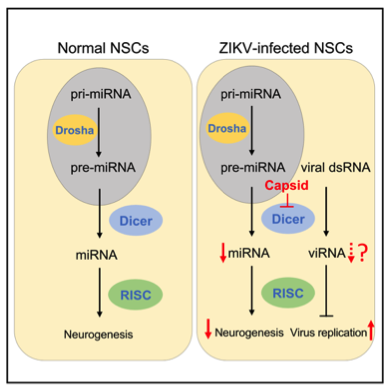
圖4:寨卡病毒C蛋白抑制Dicer加工活性,,抑制RNA干擾系統(tǒng)并最終導(dǎo)致小頭畸形示意圖
梁啟明研究員2016年加入上海交通大學(xué)醫(yī)學(xué)院/上海市免疫學(xué)研究所,課題組聚焦于新發(fā)病毒的免疫逃逸機制和致病機理,。課題組受到國家重點研發(fā)計劃,、國家自然科學(xué)基金、上海市教委,、科委,、衛(wèi)健委、以及上海市免疫學(xué)研究所的資助,并得到上海交通大學(xué)基礎(chǔ)醫(yī)學(xué)院和上海市兒童醫(yī)院基礎(chǔ)-臨床創(chuàng)新研究中心的支持,。同時,,該研究還獲得了上海交通大學(xué)醫(yī)學(xué)院張健教授、上海巴斯德研究所龍鋼研究員,、Tulane大學(xué)Shitao Li教授,、武漢大學(xué)付碧石教授和浙江工商大學(xué)酈萍教授的支持幫助。
文章鏈接:https://www.cell.com/cell-stem-cell/fulltext/S1934-5909(20)30350-7
撰稿:董澍芃
編輯:馮昫皎
審核:方麗娟
 滬公網(wǎng)安備 31009102000053號 滬ICP備18007527號-1 郵箱:[email protected]
滬公網(wǎng)安備 31009102000053號 滬ICP備18007527號-1 郵箱:[email protected] 滬公網(wǎng)安備 31009102000053號 滬ICP備18007527號-1 郵箱:[email protected]
滬公網(wǎng)安備 31009102000053號 滬ICP備18007527號-1 郵箱:[email protected]