1


γδT細(xì)胞是一類主要存在于在粘膜組織中的T細(xì)胞亞群,在免疫監(jiān)測(cè)、組織穩(wěn)態(tài)及感染免疫等方面發(fā)揮重要作用。盡管γδT細(xì)胞和αβT細(xì)胞都起源于共同的胸腺T祖細(xì)胞,但有關(guān)γδT細(xì)胞發(fā)育和分化的調(diào)節(jié)機(jī)制仍知之甚少。N6-甲基腺嘌呤(N6-Methyladenosine, m6A)RNA修飾是存在于真核生物mRNA表觀遺傳修飾中的最普遍化學(xué)修飾之一,廣泛參與機(jī)體的多種生理和病理過(guò)程。上海市免疫學(xué)研究所李華兵研究員團(tuán)隊(duì)致力于RNA表觀遺傳調(diào)控對(duì)免疫細(xì)胞發(fā)育、穩(wěn)態(tài)和功能的研究,近年來(lái)陸續(xù)闡明了m6A在各類免疫細(xì)胞發(fā)育、穩(wěn)態(tài)、分化和功能維持中的重要作用和分子機(jī)制1,2,3,4,5,6,但m6A修飾在胸腺T細(xì)胞早期發(fā)育和T細(xì)胞命運(yùn)選擇決定中的作用仍然未知。
本項(xiàng)研究中,研究團(tuán)隊(duì)發(fā)現(xiàn)胸腺T淋巴細(xì)胞中m6A去甲基酶ALKBH5缺失(ALKBH5fl/flLckCre)可特異性誘導(dǎo)γδT細(xì)胞的擴(kuò)增,但并不影響αβT細(xì)胞的發(fā)育和功能,從而增強(qiáng)對(duì)胃腸道鼠傷寒沙門菌感染的保護(hù)。為了證明對(duì)小鼠傷寒沙門菌感染的保護(hù)來(lái)自于增加的γδT細(xì)胞,研究團(tuán)隊(duì)利用TCRδ-/-; ALKBH5fl/flLckCre小鼠模型刪除γδT細(xì)胞而保留αβT細(xì)胞,結(jié)果顯示保護(hù)作用消失。在ALKBH5fl/fl CD4Cre小鼠感染模型實(shí)驗(yàn)中也未發(fā)現(xiàn)敲除ALKBH5的αβT細(xì)胞能夠起到保護(hù)作用,進(jìn)一步排除了ALKBH5fl/flLckCre感染模型實(shí)驗(yàn)中ALKBH5在αβT細(xì)胞的功能。流式分析發(fā)現(xiàn),ALKBH5fl/flLckCre小鼠胸腺T淋巴細(xì)胞中ALKBH5的缺失顯著增加了雙陰性(DN)階段(特別是DN2和DN3階段)中γδT前體各個(gè)亞群細(xì)胞的比例和數(shù)量。同時(shí),體內(nèi)BrdU實(shí)驗(yàn)揭示ALKBH5敲除自胚胎~E14.5時(shí)期開(kāi)始即可顯著促進(jìn)γδT前體細(xì)胞的增殖能力。
Notch信號(hào)參與調(diào)節(jié)T淋巴細(xì)胞的發(fā)育和功能維持7,Notch受體與配體的相互作用參與了T淋巴細(xì)胞分化過(guò)程中細(xì)胞命運(yùn)的決定8,9,10,11。在人類中,Jagged1主要誘導(dǎo)αβT細(xì)胞分化,而Jagged2介導(dǎo)的Notch3激活主要促進(jìn)γδT細(xì)胞的發(fā)育,并通過(guò)阻礙TCRβ形成抑制αβT細(xì)胞的分化9。為了闡明m6A調(diào)控γδT細(xì)胞增殖的分子機(jī)制,研究團(tuán)隊(duì)結(jié)合先前T細(xì)胞中m6A-RIP-Seq數(shù)據(jù),通過(guò)質(zhì)譜分析、RNA-seq分析、m6A-RIP-PCR、RNA decay等實(shí)驗(yàn),證實(shí)了ALKBH5缺失增加胸腺T前體細(xì)胞中m6A RNA修飾的豐度,并通過(guò)促進(jìn)Notch信號(hào)關(guān)鍵靶基因Jagged1和Notch2 mRNA的降解來(lái)促進(jìn)γδT前體細(xì)胞的增殖(見(jiàn)圖1)。隨后,研究團(tuán)隊(duì)進(jìn)一步構(gòu)建了Jagged1fl/flLckCre小鼠模型,驗(yàn)證了Jagged1信號(hào)缺失與ALKBH5敲除的表型一致,均促進(jìn)γδT前體細(xì)胞的增殖,從而增加了成熟γδT的數(shù)量,進(jìn)而可以更好的保護(hù)小鼠免受胃腸道鼠傷寒沙門菌的感染。
綜上,該研究表明ALKBH5介導(dǎo)的m6A mRNA修飾通過(guò)調(diào)節(jié)Jagged1/Notch2信號(hào)通路在胸腺T細(xì)胞早期發(fā)育和T細(xì)胞命運(yùn)選擇決定中發(fā)揮了重要的檢查點(diǎn)作用,加深了我們對(duì)m6A在特定微環(huán)境和免疫細(xì)胞中生理學(xué)功能的理解,揭示了前體T細(xì)胞早期發(fā)育過(guò)程中的RNA表觀遺傳學(xué)調(diào)控機(jī)制。
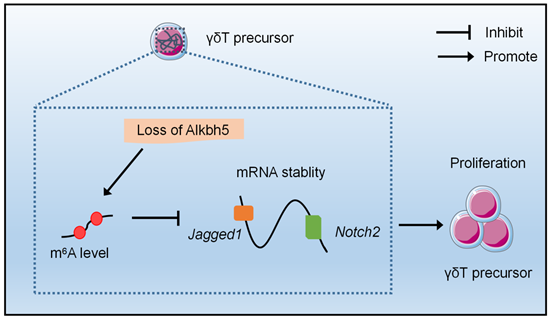
圖1.m6A/ALKBH5通過(guò)靶向調(diào)控Jagged1/Notch2信號(hào)通路,在γδT細(xì)胞早期發(fā)育中發(fā)揮重要調(diào)控作用
上海交通大學(xué)醫(yī)學(xué)院上海市免疫學(xué)研究所博士后丁陳波和余志斌,及耶魯大學(xué)醫(yī)學(xué)院博士生徐昊為本論文的共同第一作者,上海交通大學(xué)醫(yī)學(xué)院-上海市免疫學(xué)研究所李華兵研究員、耶魯大學(xué)醫(yī)學(xué)院Richard Flavell院士、上海交通大學(xué)醫(yī)學(xué)院附屬瑞金醫(yī)院胡偉國(guó)教授為該文的共同通訊作者。該研究得到國(guó)家自然科學(xué)基金重點(diǎn)項(xiàng)目、面上項(xiàng)目以及科技部國(guó)家重點(diǎn)研發(fā)計(jì)劃等項(xiàng)目的資助。

李華兵,研究員,博士生導(dǎo)師。2002年本科畢業(yè)于南開(kāi)大學(xué)并于2005年獲得南開(kāi)大學(xué)碩士學(xué)位,2011年在新澤西州立大學(xué)獲得博士學(xué)位,2017年在耶魯大學(xué)完成博士后研究。2017年8月正式入職上海交通大學(xué)醫(yī)學(xué)院上海市免疫學(xué)研究所擔(dān)任課題組長(zhǎng),建立RNA表觀免疫課題組。最近五年的相關(guān)研究成果以通訊(含共同通訊)作者發(fā)表在國(guó)際權(quán)威雜志Nature Immunology、PNAS、Cell Research、Science Advances(3篇)、Nature Communications、Molecular Cancer和Nature、Immunity、Cell Reports等一系列雜志上。作為項(xiàng)目負(fù)責(zé)人主持國(guó)家自然科學(xué)基金委國(guó)際合作與交流項(xiàng)目(2021)、重點(diǎn)項(xiàng)目(2020)、面上項(xiàng)目(2020)、重大研究計(jì)劃培育項(xiàng)目(2017)、兩項(xiàng)上海市“科技創(chuàng)新行動(dòng)計(jì)劃”項(xiàng)目(2020),獲得科技部重點(diǎn)研發(fā)計(jì)劃子課題資助,并入選國(guó)家高層次海外人才青年項(xiàng)目(2017)和上海市“東方學(xué)者”特聘教授等人才項(xiàng)目。
李華兵課題組近年來(lái)深入系統(tǒng)地研究RNA修飾如何調(diào)控免疫細(xì)胞的功能以及在腸道炎癥和腫瘤發(fā)生發(fā)展中的作用,現(xiàn)根據(jù)課題研究的需要,課題組面向社會(huì)公開(kāi)招聘,歡迎更多優(yōu)秀的人才(包括博士后和技術(shù)員)加入團(tuán)隊(duì)共同推進(jìn)課題進(jìn)展,課題組將為擬加入的成員提供上海地區(qū)具有競(jìng)爭(zhēng)力的待遇、一流的研究平臺(tái)和良好的發(fā)展前景。課題組更多詳情參考實(shí)驗(yàn)室網(wǎng)頁(yè):https://hua-binglilab.com/。
 滬公網(wǎng)安備 31009102000053號(hào) 滬ICP備18007527號(hào)-1 郵箱:[email protected]
滬公網(wǎng)安備 31009102000053號(hào) 滬ICP備18007527號(hào)-1 郵箱:[email protected]