

TCR作為T細胞活化的第一信號通過識別抗原-MHC啟動跨膜信號,觸發(fā)位于CD3胞質(zhì)段(cytoplasmic domain, CD3CD)的免疫受體酪氨酸激活基序(immunoreceptor tyrosine-based activation motifs, ITAMs)磷酸化,從而激活T細胞下游的系列反應(yīng)介導(dǎo)特異性免疫應(yīng)答。TCR/CD3復(fù)合體的信號機制一直是適應(yīng)性免疫領(lǐng)域探索的核心科學(xué)問題,其中膜脂類物質(zhì)作為細胞膜的主要成分可參與膜蛋白TCR/CD3復(fù)合體的信號調(diào)節(jié)。王鋒團隊前期發(fā)現(xiàn)CS可通過取代膽固醇破壞TCR的聚集并抑制TCR信號轉(zhuǎn)導(dǎo)[1]。哈爾濱工業(yè)大學(xué)黃志偉課題組最近通過結(jié)構(gòu)生物學(xué)技術(shù)證明CS與TCR的結(jié)合比膽固醇具有更強的競爭性[2]。中國科學(xué)院許琛琦課題組系列工作提出了TCR-CD3復(fù)合體變構(gòu)模型[3、4],證明細胞膜內(nèi)酸性磷脂(-)與CD3CD區(qū)域(+)通過電荷相互作用,將CD3亞基胞內(nèi)段的ITAM鎖定在細胞膜抑制TCR信號,而Ca2+刺激可破壞這種結(jié)合釋放ITAM啟動TCR信號傳導(dǎo)。
該研究發(fā)現(xiàn),帶有負電硫酸基團的膜脂類分子CS可通過與帶正電的CD3ε胞內(nèi)段相互作用,形成穩(wěn)定的二級結(jié)構(gòu)鎖定CD3ε胞質(zhì)段與細胞膜的結(jié)合,由此防止Ca2+刺激下CD3ε-ITAM從細胞膜的釋放,高效抑制TCR信號轉(zhuǎn)導(dǎo)。通過進一步探索發(fā)現(xiàn)位于CD3ε-ITAM內(nèi)的二級結(jié)構(gòu)形成的關(guān)鍵位點(I191,YxxI-x6–8-YxxL),I191突變破壞了CS與CD3ε-ITAM形成的二級結(jié)構(gòu)的穩(wěn)定性,恢復(fù)并強化了CD3亞基對Ca2+的敏感性,從而顯著增強TCR信號能力(圖1)。重要的是,利用基因編輯技術(shù)在小鼠或人的TCR-T細胞引入CD3ε-I/A突變后,可以通過增加效應(yīng)細胞因子分泌、增強腫瘤殺傷和提升腫瘤浸潤T細胞干性擴增等多種途徑,全面提升生理TCR-抗原親和力范圍內(nèi)的各類TCR-T細胞的體內(nèi)外抗腫瘤效力。該研究首次通過揭示TCR/CD3復(fù)合體信號調(diào)節(jié)機制,實現(xiàn)理性設(shè)計信號增強型TCR-T細胞的腫瘤免疫治療策略,為日后進一步在臨床上提升實體瘤免疫細胞療效奠定了堅實的理論基礎(chǔ)(圖2)。
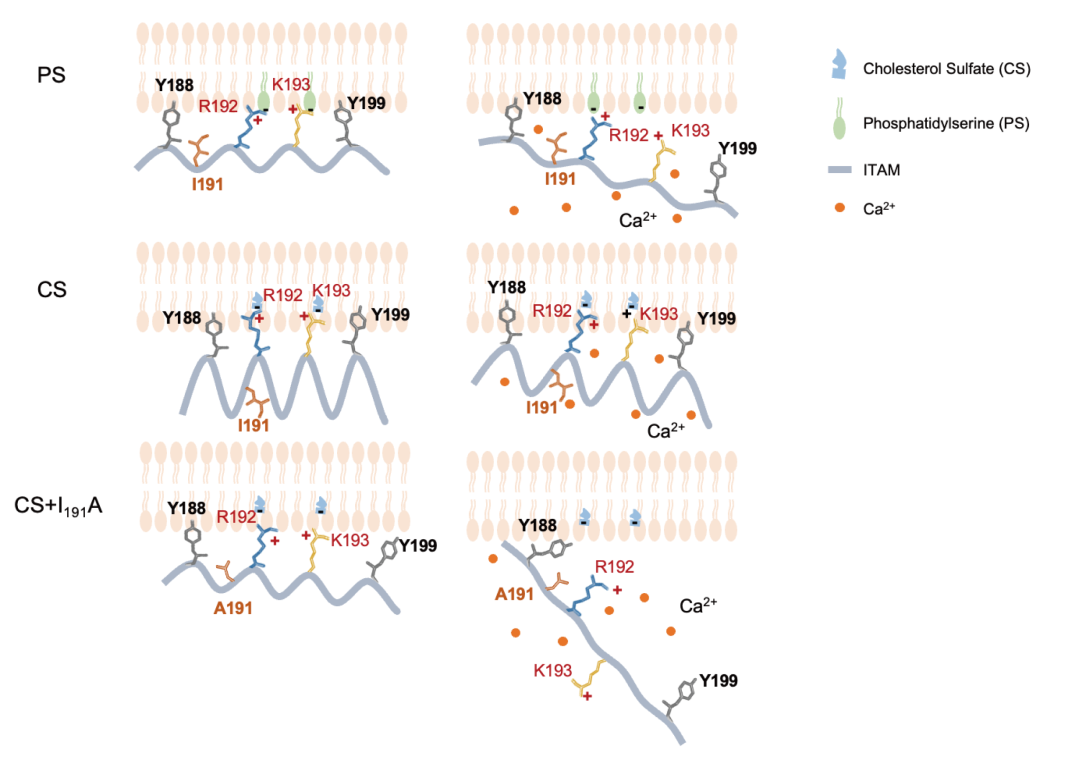
圖1. CS通過影響CD3ε構(gòu)象變化調(diào)控TCR信號新機制
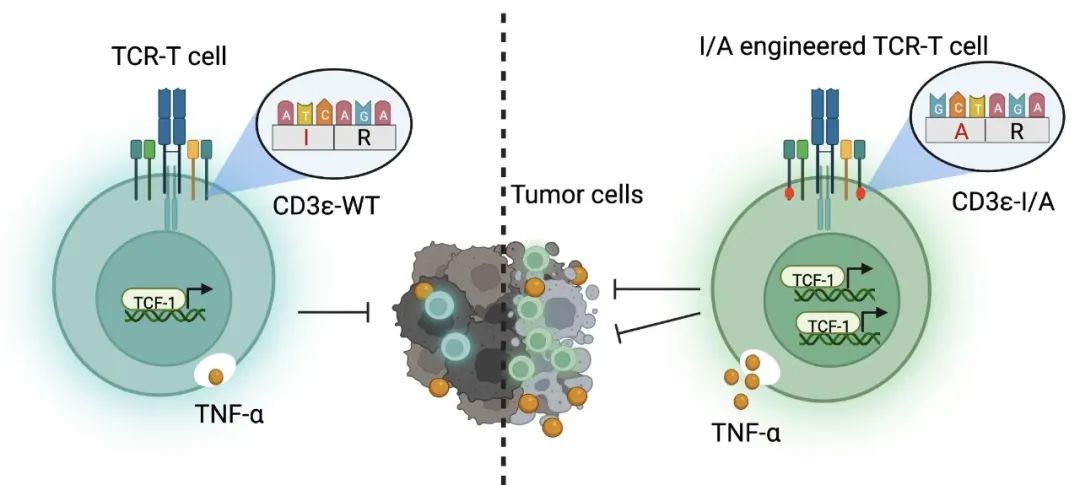
圖2. CD3ε-ITAM I/A突變增強TCR-T細胞抗腫瘤效應(yīng)
上海交通大學(xué)醫(yī)學(xué)院上海市免疫學(xué)研究所王鋒研究員為論文通訊作者,博士研究生梁文華,博士后蟻瑞榮(已出站),科研助理王為芳為論文的共同第一作者。研究還得到華東師范大學(xué)張楫欽博士和劉明耀教授等的大力支持。該研究工作受國家自然科學(xué)基金委員會,國家重點研發(fā)計劃,上海市科學(xué)技術(shù)委員會,上海市地方高水平大學(xué)協(xié)同創(chuàng)新團隊和醫(yī)學(xué)基因組學(xué)國家重點實驗室等經(jīng)費支持。

王鋒,研究員,博士生導(dǎo)師,上海交通大學(xué)醫(yī)學(xué)院上海市免疫學(xué)研究所課題組長(PI)。2005年本科畢業(yè)于北京師范大學(xué)生命科學(xué)學(xué)院,2010年獲得北京師范大學(xué)和北京生命科學(xué)研究所聯(lián)合培養(yǎng)博士學(xué)位。2010-2016年在斯坦福大學(xué)師從T細胞受體發(fā)現(xiàn)者,美國國家科學(xué)院院士Mark M. Davis教授進行博士后訓(xùn)練。長期致力于T細胞抗原識別和信號轉(zhuǎn)導(dǎo)的代謝調(diào)節(jié)機制研究。以通訊/第一作者在Nature Immunology(2016), PNAS(2018,2020), BMC Biology(2020),Cell Discovery(2021), Theranostics(2021),EMBO Journal(2022)等國際知名學(xué)術(shù)期刊發(fā)表系列研究論文。入選國家高層次青年拔尖人才,上海高校特聘教授(東方學(xué)者),上海市青年拔尖人才和浦江人才計劃。近五年帶領(lǐng)團隊承擔包括國家自然科學(xué)基金重點項目和國家重點研發(fā)計劃在內(nèi)的國家級課題11項,上海市科委和上海市衛(wèi)健委資助的省部級項目4項。
王鋒課題組近年來深入研究TCR抗原識別機制和抗原特異性T細胞在腫瘤等重大疾病中的作用,現(xiàn)根據(jù)課題組研究的需要,面向社會公開招聘,歡迎更多優(yōu)秀人才加入團隊共同推進課題進展,課題組將為加入的成員提供具有競爭力的待遇、一流的研究平臺和良好的發(fā)展前景。相關(guān)申請事項請郵件聯(lián)系:wangfeng16ATsjtu.edu.cn。
【參考文獻】
1. Wang, F., et al., Inhibition of T cell receptor signaling by cholesterol sulfate, a naturally occurring derivative of membrane cholesterol. Nat Immunol, 2016. 17(7): p. 844-50.
2. Chen, Y., et al., Cholesterol inhibits TCR signaling by directly restricting TCR-CD3 core tunnel motility. Mol Cell, 2022. 82(7): p. 1278-1287.e5.
3. Xu, C., et al., Regulation of T cell receptor activation by dynamic membrane binding of the CD3epsilon cytoplasmic tyrosine-based motif. Cell, 2008. 135(4): p. 702-13.
4. Shi, X., et al., Ca2+ regulates T-cell receptor activation by modulating the charge property of lipids. Nature, 2013. 493(7430): p. 111-5.
 滬公網(wǎng)安備 31009102000053號 滬ICP備18007527號-1 郵箱:[email protected]
滬公網(wǎng)安備 31009102000053號 滬ICP備18007527號-1 郵箱:[email protected] 滬公網(wǎng)安備 31009102000053號 滬ICP備18007527號-1 郵箱:[email protected]
滬公網(wǎng)安備 31009102000053號 滬ICP備18007527號-1 郵箱:[email protected]