高級別漿液性卵巢癌(HGSOC)是最常見的卵巢癌亞型,,75%以上的患者首診時已是晚期,且常伴有廣泛的網(wǎng)膜轉(zhuǎn)移和腹水產(chǎn)生[1],。盡管化療與貝伐珠單抗(bevacizumab)聯(lián)合使用可以延長卵巢癌患者的五年生存期,,但對治療有響應(yīng)的卵巢癌病人僅在10%左右。此外,,已有研究表明卵巢癌腹水中的成纖維細(xì)胞亞群可以通過激活腫瘤細(xì)胞中的JAK/STAT通路以影響患者的預(yù)后及其對免疫治療的響應(yīng)[2],。然而,卵巢癌腹水環(huán)境中的其它細(xì)胞類群對其腫瘤微環(huán)境的影響方式和途徑仍不明確,。
研究團(tuán)隊(duì)收集了來自14例卵巢癌患者的包括原發(fā)灶,、轉(zhuǎn)移灶、腹水、外周血以及盆腔淋巴結(jié)在內(nèi)5個部位共39例樣本,,并對所有樣本進(jìn)行單細(xì)胞轉(zhuǎn)錄組測序和T細(xì)胞受體(TCR)測序,。首先,研究人員通過分析不同部位樣本內(nèi)T細(xì)胞類群的組成情況,,發(fā)現(xiàn)在實(shí)體腫瘤組織中主要富集耗竭T細(xì)胞(Tex)及調(diào)節(jié)性T細(xì)胞(Treg)等免疫抑制型T細(xì)胞,,而腹水中富集的則多為效應(yīng)T細(xì)胞(Teff)和記憶T細(xì)胞(Tcm/Tem)。盡管在所有病人的腹水樣本中均可以檢測到腫瘤細(xì)胞的存在,,但該結(jié)果表明,,腹水微環(huán)境并未呈現(xiàn)出腫瘤內(nèi)部的強(qiáng)烈免疫抑制性狀態(tài)。
為了深入探索腫瘤和腹水中T細(xì)胞類群的發(fā)育關(guān)系,,研究人員以TCR作為標(biāo)簽,,使用STARTRAC算法[3]對本研究中鑒定出的10種不同類型T細(xì)胞進(jìn)行追蹤和定量分析,發(fā)現(xiàn)腫瘤組織中浸潤的Tex細(xì)胞與腹水中富集的CD8+GZMK+Tem之間存在高度TCR共享,。進(jìn)一步分析發(fā)現(xiàn),,相較于原發(fā)灶,腹水中的Tem細(xì)胞更傾向與轉(zhuǎn)移灶中的Tex細(xì)胞共享TCR,。此外,腫瘤中Tex細(xì)胞與腹水中Tem細(xì)胞之間的聯(lián)系(Tex-Tem in ascites)與其與腫瘤中Tem細(xì)胞之間的聯(lián)系(Tex-Tem in tumor)是互相排斥的(mutually exclusive),。由于終末分化Tex細(xì)胞具有不可逆轉(zhuǎn)的細(xì)胞狀態(tài)和較差的組織遷移能力,,因此以上結(jié)果提示腹水中的CD8+GZMK+Tem細(xì)胞具有浸潤至腫瘤組織中并直接轉(zhuǎn)化為Tex細(xì)胞的能力。研究人員在CD4+T細(xì)胞的分析中也發(fā)現(xiàn)了類似的現(xiàn)象,,腹水中的CD4+Tcm與腫瘤組織中的CD4+CXCL13+Th1樣細(xì)胞同樣存在高度TCR共享,,揭示其很可能是腫瘤組織中Th1樣細(xì)胞的前體來源。綜合分析顯示腹水中富集的記憶T細(xì)胞是腫瘤浸潤終末狀態(tài)T細(xì)胞極為重要的補(bǔ)充池(pool),,揭示了腹水在塑造腫瘤微環(huán)境中發(fā)揮的關(guān)鍵作用(圖1),。
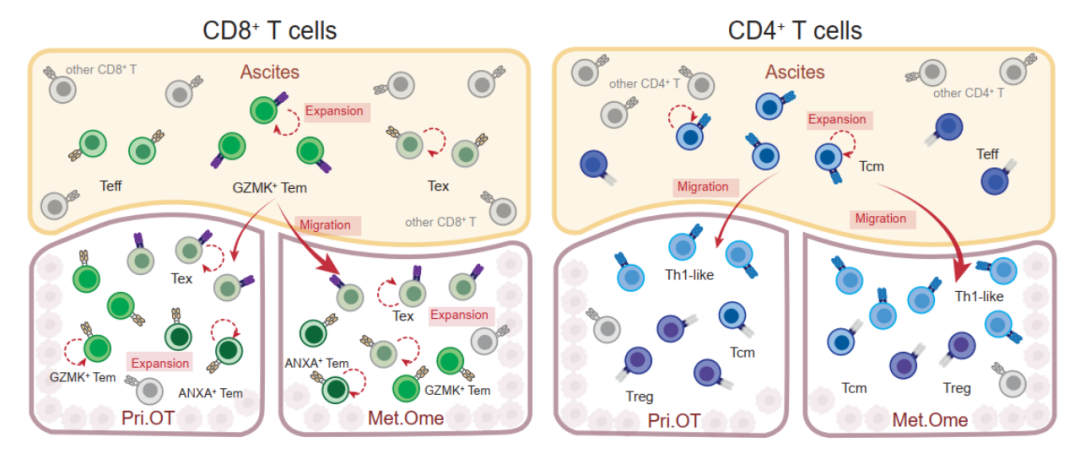
圖1 腫瘤和腹水間不同T細(xì)胞亞群間的譜系關(guān)系
腫瘤相關(guān)巨噬細(xì)胞(TAM)是腫瘤免疫微環(huán)境中不可或缺的部分,發(fā)揮著重要的免疫調(diào)控作用,?;诓煌慕M織來源特征,研究團(tuán)隊(duì)首先將巨噬細(xì)胞亞群分為腫瘤富集的巨噬細(xì)胞(tumor-enriched macrophage, TeMac)和腹水富集的巨噬細(xì)胞(ascites-enriched macrophage, AeMac)兩大類群,。通過比較兩群巨噬細(xì)胞的功能發(fā)現(xiàn),,TeMac高表達(dá)VEGFA及CCL3、CXCL12等細(xì)胞因子,,具有較強(qiáng)的T細(xì)胞招募能力,。AeMac則上調(diào)LYVE1及CD163等組織駐留巨噬細(xì)胞(resident-tissue macrophage, RTM)的特征基因??紤]到腹水的液體環(huán)境,,研究人員對腫瘤和腹水中巨噬細(xì)胞的來源進(jìn)一步進(jìn)行探索。通過比較各巨噬細(xì)胞亞群的RTM得分并結(jié)合Ms4a3Cre-RosaTdT譜系示蹤小鼠模型發(fā)現(xiàn),盡管卵巢癌腫瘤組織中的巨噬細(xì)胞主要為單核細(xì)胞來源,,但仍存在著少量具有較強(qiáng)RTM特征的巨噬細(xì)胞(M10),。與之相反,RTM是腹水中巨噬細(xì)胞的重要來源及主要組成部分,。此外,,本研究還整合分析了來自結(jié)直腸癌和肝癌的髓系免疫細(xì)胞類群。綜合研究發(fā)現(xiàn),,盡管不同癌種,、不同組織來源的巨噬細(xì)胞亞群表現(xiàn)出較強(qiáng)的異質(zhì)性,但卵巢癌腹水的巨噬細(xì)胞亞群M08,、M09和M14仍與肝癌腹水的M-C6-MARCO亞群聚為一類,。以上結(jié)果表明,微環(huán)境和發(fā)育來源共同影響著巨噬細(xì)胞的功能特征(圖2) ,。
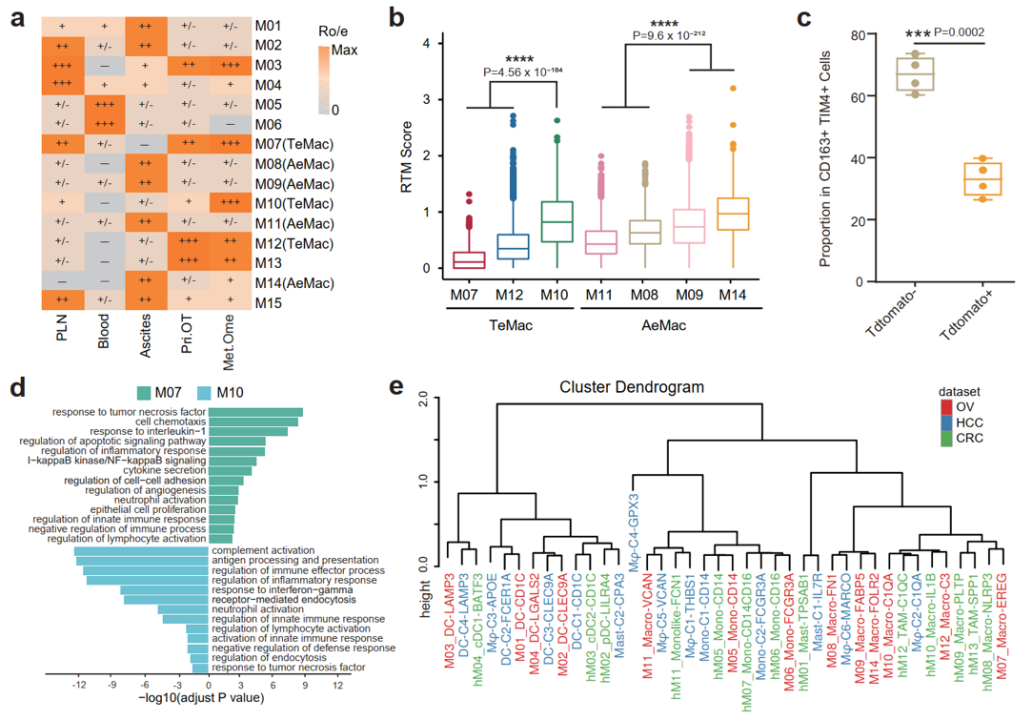
圖2 卵巢癌腹水及腫瘤組織微環(huán)境中不同功能表型和發(fā)育來源的巨噬細(xì)胞
卵巢癌患者手術(shù)后的基礎(chǔ)治療通常為鉑類化療,,本研究涉及的卵巢癌患者有4例為化療耐藥及9例為化療敏感。研究人員通過比較不同化療響應(yīng)情況的患者治療前樣本中細(xì)胞亞群的分布情況,,發(fā)現(xiàn)腫瘤原位灶中VCAM+內(nèi)皮細(xì)胞占比較高的HGSOC患者對化療敏感,,而IL13RA1+內(nèi)皮細(xì)胞的富集則提示患者對化療耐藥。此外,,腹水中高比例的MAIT細(xì)胞(mucosal-associated invariant T cells)和cDC1細(xì)胞亦可提示HGSOC患者對化療的敏感性(圖3),。
圖3 卵巢癌中影響患者對化療敏感性的細(xì)胞類群
綜上,該研究通過構(gòu)建涵蓋卵巢癌多部位的單細(xì)胞圖譜,,揭示了腫瘤不同部位微環(huán)境內(nèi)細(xì)胞類群間的動態(tài)變化和調(diào)控關(guān)系,,明確了卵巢癌腹水對腫瘤免疫微環(huán)境的塑造作用,同時發(fā)現(xiàn)了可用于預(yù)測卵巢癌化療療效的特定細(xì)胞亞型,,為卵巢癌的基礎(chǔ)研究和臨床診治提供了重要理論基礎(chǔ),。
上海交通大學(xué)醫(yī)學(xué)院附屬新華醫(yī)院汪希鵬教授,北京大學(xué)生物醫(yī)學(xué)前沿創(chuàng)新中心(BIOPIC)張澤民教授以及上海交通大學(xué)醫(yī)學(xué)院上海市免疫學(xué)研究所博士后李子逸為本文的共同通訊作者,。上海交通大學(xué)醫(yī)學(xué)院附屬新華醫(yī)院博士研究生鄭小翠,、王昕婧,復(fù)旦大學(xué)附屬腫瘤醫(yī)院婦科醫(yī)師程璽為該論文并列第一作者,。上海市免疫學(xué)研究所Florent Ginhoux組李子逸博士后參與了本研究的實(shí)驗(yàn)設(shè)計(jì),,并指導(dǎo)了單細(xì)胞數(shù)據(jù)分析和挖掘的工作。Florent Ginhoux團(tuán)隊(duì)的劉兆遠(yuǎn)副研究員,、郭薇博士后為該工作中用到的Ms4a3Cre-RosaTdT譜系示蹤小鼠模型和流式細(xì)胞分析提供了大力支持,。

李子逸,上海市免疫學(xué)研究所Florent Ginhoux課題組博士后,,余?博士后,、上海超級博士后獲得者。2020年博士畢業(yè)于北京大學(xué),師從癌癥生物學(xué)及生物信息學(xué)專家張澤民教授,,主要從事腫瘤免疫微環(huán)境單細(xì)胞功能與組學(xué)技術(shù)應(yīng)用研究,,包括揭示不同靶向髓系免疫治療策略的潛在作用機(jī)理(Cell, 2020),系統(tǒng)性地解析腫瘤浸潤髓系細(xì)胞的特征及動態(tài)關(guān)系(Cell, 2021),。2020年8月加入上海市免疫學(xué)研究所Florent Ginhoux教授課題組從事博士后研究,,主要從事髓系免疫細(xì)胞在正常組織、病理狀態(tài)及腫瘤中發(fā)育及功能的研究,。入選余?博士后計(jì)劃(2020)與求索博士后計(jì)劃(2021),,獲上海市“超級博士后“激勵計(jì)劃資助(2020),國家自然科學(xué)基金青年基金資助(2022),。博后期間研究成果以第一作者(含并列第一作者)或通訊作者身份在Nature Cancer, Immunity等期刊發(fā)表,。
【參考文獻(xiàn)】
1. Lheureux, S., et al., Epithelial ovarian cancer. Lancet, 2019. 393(10177): p. 1240-1253.
2. Izar, B., et al., A single-cell landscape of high-grade serous ovarian cancer. Nat Med, 2020. 26(8): p. 1271-1279.
3. Bian, Z., et al., Deciphering human macrophage development at single-cell resolution. Nature, 2020. 582(7813): p. 571-576.
 滬公網(wǎng)安備 31009102000053號 滬ICP備18007527號-1 郵箱:sii@shsmu.edu.cn
滬公網(wǎng)安備 31009102000053號 滬ICP備18007527號-1 郵箱:sii@shsmu.edu.cn