調(diào)節(jié)性T細(xì)胞是維持機(jī)體免疫穩(wěn)態(tài)的FOXP3+ CD4+ T細(xì)胞亞群,同時也是腫瘤微環(huán)境中構(gòu)建免疫抑制屏障的重要組成細(xì)胞1,2。已有研究表明,靶向腫瘤浸潤的Treg細(xì)胞,誘導(dǎo)出其脆性狀態(tài)會顯著增強(qiáng)抗腫瘤免疫,脆性狀態(tài)的Treg(Fragile-like Regulatory T cells)通常伴隨著抑制功能下降,轉(zhuǎn)錄因子FOXP3表達(dá)下調(diào),IFNγ等腫瘤殺傷性細(xì)胞因子分泌增加3,4。但目前有關(guān)脆性Treg細(xì)胞功能穩(wěn)定性的調(diào)節(jié)機(jī)制尚不清楚,為開發(fā)靶向腫瘤組織Treg細(xì)胞的免疫療法帶來了挑戰(zhàn)。
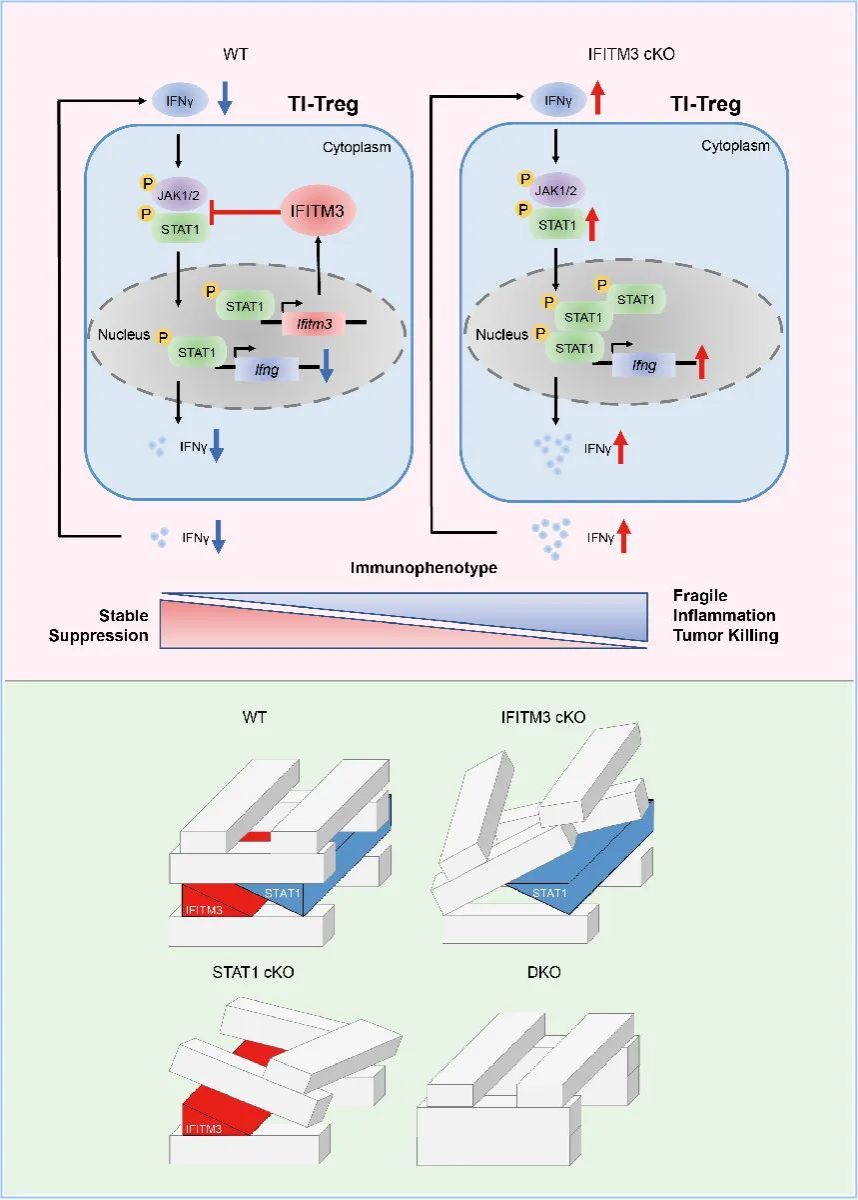
本研究中,研究團(tuán)隊通過臨床樣本檢測與表達(dá)相關(guān)性分析,鑒定出了與腫瘤浸潤Treg細(xì)胞功能密切相關(guān)的基因Ifitm3。Treg細(xì)胞特異性缺失IFITM3的小鼠顯示出更強(qiáng)的抗腫瘤免疫反應(yīng),且其腫瘤浸潤Treg細(xì)胞轉(zhuǎn)變?yōu)槊庖咭种菩怨δ芟抡{(diào)、腫瘤殺傷性功能上調(diào)的脆性狀態(tài)。通過對IFITM3作用機(jī)制的深入研究,團(tuán)隊成員發(fā)現(xiàn)IFITM3蛋白能夠與IFNγ信號通路中的JAK1/2-STAT1蛋白復(fù)合體結(jié)合,抑制STAT1蛋白的磷酸化從而抑制STAT1對下游基因的轉(zhuǎn)錄調(diào)控。有趣的是,同樣作為IFNγ誘導(dǎo)產(chǎn)生的基因,STAT1也會反向調(diào)控Ifitm3的基因轉(zhuǎn)錄與蛋白表達(dá)。在Treg細(xì)胞中敲除Stat1后,IFITM3的轉(zhuǎn)錄水平與蛋白水平會明顯下調(diào)。這提示在腫瘤微環(huán)境中IFNγ的刺激下,STAT1與IFITM3在Treg細(xì)胞中形成一個相互調(diào)節(jié)的負(fù)反饋環(huán)路。當(dāng)STAT1表達(dá)增強(qiáng)時,IFITM3表達(dá)水平增高并反向抑制其表達(dá),這樣的調(diào)控機(jī)制使兩個功能蛋白在Treg細(xì)胞內(nèi)維持著相對穩(wěn)定的表達(dá)狀態(tài)。
為了進(jìn)一步證明擾動此負(fù)反饋環(huán)路對于腫瘤浸潤Treg細(xì)胞功能穩(wěn)定性的影響,研究人員進(jìn)一步在Ifitm3條件性敲除小鼠 (CKO),Stat1條件性敲除小鼠(SKO),以及兩基因雙重條件性敲除小鼠 (DKO)中構(gòu)建皮下瘤移植模型。檢測結(jié)果顯示,與野生型(WT)小鼠相比,CKO小鼠與SKO小鼠腫瘤均顯著變小,且腫瘤浸潤的Treg細(xì)胞均出現(xiàn)脆性特征,進(jìn)而增強(qiáng)了抗腫瘤反應(yīng)。而DKO的小鼠并沒有表現(xiàn)出抗腫瘤能力的下降,其腫瘤浸潤的Treg細(xì)胞也沒有出現(xiàn)脆性狀態(tài)。
綜上,研究團(tuán)隊提出,STAT1-IFITM3反饋環(huán)路可能是Treg特異性抗腫瘤療法的一個潛在靶點。阻斷STAT1或IFITM3的表達(dá)能夠擾動其環(huán)路的平衡,進(jìn)而導(dǎo)致Treg出現(xiàn)功能不穩(wěn)定的脆性狀態(tài),而同時阻斷兩者則不會有此作用,提示對腫瘤浸潤Treg細(xì)胞的功能調(diào)節(jié)依賴擾動環(huán)路平衡而并不是徹底去除此環(huán)路。這為腫瘤浸潤Treg細(xì)胞功能與穩(wěn)定性的研究提供了新的理論依據(jù),也為臨床上以擾動Treg細(xì)胞內(nèi)信號環(huán)路平衡作為增強(qiáng)抗腫瘤免疫治療靶點提供了新思路。
上海交通大學(xué)醫(yī)學(xué)院上海市免疫學(xué)研究所博士生劉鑫男,張煒奇,上海交通大學(xué)醫(yī)學(xué)院附屬瑞金醫(yī)院博士生韓逸超,上海市免疫學(xué)研究所及中國科學(xué)院深圳先進(jìn)技術(shù)研究院博士后成浩,以及上海交通大學(xué)醫(yī)學(xué)院基礎(chǔ)醫(yī)學(xué)院生化與分子生物學(xué)系博士生劉琪為本文的共同第一作者。中國科學(xué)院深圳先進(jìn)技術(shù)研究院潘璠研究員,上海交通大學(xué)醫(yī)學(xué)院附屬瑞金醫(yī)院李鶴成主任醫(yī)師,上海交通大學(xué)醫(yī)學(xué)院上海市免疫學(xué)研究所李斌研究員為本文通訊作者。本研究得到國家科技部重點研發(fā)項目、國家自然科學(xué)基金委重點基金、上海市科委等項目資助,依托上海市免疫學(xué)研究所公共平臺、上海交通大學(xué)醫(yī)學(xué)院基礎(chǔ)醫(yī)學(xué)院公共技術(shù)平臺、上海交通大學(xué)醫(yī)學(xué)院動科部、賽業(yè)生物動科部等平臺的技術(shù)支持。本研究還得到了廣東醫(yī)科大學(xué)黃功華教授,上海交通大學(xué)醫(yī)學(xué)院上海市免疫學(xué)研究所蘇冰教授,鄒強(qiáng)研究員,李華兵研究員,上海交通大學(xué)醫(yī)學(xué)院附屬仁濟(jì)醫(yī)院趙文毅副主任醫(yī)師,上海市免疫創(chuàng)新研究院魯林榮教授,上海交通大學(xué)醫(yī)學(xué)院基礎(chǔ)醫(yī)學(xué)院童雪梅教授等合作實驗室老師和同學(xué)們的大力支持與幫助。
【參考文獻(xiàn)】
1. Tanaka, A. & Sakaguchi, S. Regulatory T cells in cancer immunotherapy. Cell Research 27, 109-118, doi:10.1038/cr.2016.151 (2017).
2. Joyce, J. A. & Fearon, D. T. T cell exclusion, immune privilege, and the tumor microenvironment. Science (New York, N.Y.) 348, 74-80, doi:10.1126/science.aaa6204 (2015).
3. Overacre-Delgoffe, A. E. & Vignali, D. A. A. Treg Fragility: A Prerequisite for Effective Antitumor Immunity? Cancer Immunology Research 6, 882-887, doi:10.1158/2326-6066.CIR-18-0066 (2018).
4. Overacre-Delgoffe, A. E. et al. Interferon-γ Drives Treg Fragility to Promote Anti-tumor Immunity. Cell 169, doi:10.1016/j.cell.2017.05.005 (2017).
 滬公網(wǎng)安備 31009102000053號 滬ICP備18007527號-1 郵箱:[email protected]
滬公網(wǎng)安備 31009102000053號 滬ICP備18007527號-1 郵箱:[email protected] 滬公網(wǎng)安備 31009102000053號 滬ICP備18007527號-1 郵箱:[email protected]
滬公網(wǎng)安備 31009102000053號 滬ICP備18007527號-1 郵箱:[email protected]