調(diào)節(jié)性T細(xì)胞(Treg)作為CD4+T細(xì)胞的獨(dú)特亞群,具有免疫抑制功能,維持免疫穩(wěn)態(tài)。Treg細(xì)胞重要標(biāo)志是表達(dá)轉(zhuǎn)錄因子Foxp3,后者調(diào)控Treg細(xì)胞的分化和功能。炎癥微環(huán)境及誘導(dǎo)慢性內(nèi)質(zhì)網(wǎng)應(yīng)激(ERS)的藥物可能導(dǎo)致Foxp3蛋白穩(wěn)定性受損,使Treg轉(zhuǎn)變?yōu)樾?yīng)T細(xì)胞樣表型,從而促進(jìn)自身效應(yīng)性T細(xì)胞和其它先天免疫細(xì)胞的激活,這一轉(zhuǎn)變成為許多自身免疫疾病出現(xiàn)的導(dǎo)火索。內(nèi)質(zhì)網(wǎng)應(yīng)激調(diào)控Foxp3穩(wěn)定性和Treg功能的機(jī)制不清楚。
內(nèi)質(zhì)網(wǎng)(ER)是分泌蛋白折疊和質(zhì)量控制的中心,錯(cuò)誤折疊的蛋白通過內(nèi)質(zhì)網(wǎng)相關(guān)降解(ERAD)途徑被識(shí)別并降解。在應(yīng)激條件下,未折疊或者錯(cuò)誤折疊的蛋白的積累激活三條內(nèi)質(zhì)網(wǎng)應(yīng)激反應(yīng)通路:IRE1α、PERK和ATF6,其中IRE1α被認(rèn)為是ERAD復(fù)合體的內(nèi)源性底物,其降解涉及E3泛素連接酶HRD1和未折疊蛋白反應(yīng)(UPR)分子伴侶BIP。IRE1α 在Treg細(xì)胞中由ERAD介導(dǎo)的降解機(jī)制仍待探討。已有研究表明酵母p24蛋白(TMED4)可以防止錯(cuò)誤折疊的蛋白進(jìn)入內(nèi)質(zhì)網(wǎng)分泌的囊泡,并且其表達(dá)能被多種ERS誘導(dǎo)劑激活,TMED4是否參與Treg細(xì)胞ERS調(diào)控及其具體機(jī)制仍然不為所知。
內(nèi)質(zhì)網(wǎng)應(yīng)激反應(yīng)在T細(xì)胞和Treg細(xì)胞中發(fā)揮著重要作用。與其他CD4+T細(xì)胞不同,Treg細(xì)胞主要依賴線粒體氧化磷酸化(OXPHOS)來滿足其能量需求;另外,內(nèi)質(zhì)網(wǎng)應(yīng)激反應(yīng)和線粒體OXPHOS缺陷是細(xì)胞活性氧(ROS)的主要來源,抗氧化轉(zhuǎn)錄因子NRF2參與清除ROS。由于內(nèi)質(zhì)網(wǎng)應(yīng)激誘導(dǎo)的UPR高度依賴氧化還原信號(hào)的響應(yīng),線粒體OXPHOS和細(xì)胞ROS水平的波動(dòng)將對(duì)Treg細(xì)胞的功能至關(guān)重要,并且Treg細(xì)胞中內(nèi)質(zhì)網(wǎng)應(yīng)激反應(yīng)、線粒體OXPHOS和抗氧化反應(yīng)之間的相互作用機(jī)制和調(diào)控網(wǎng)絡(luò)也需深入探索。
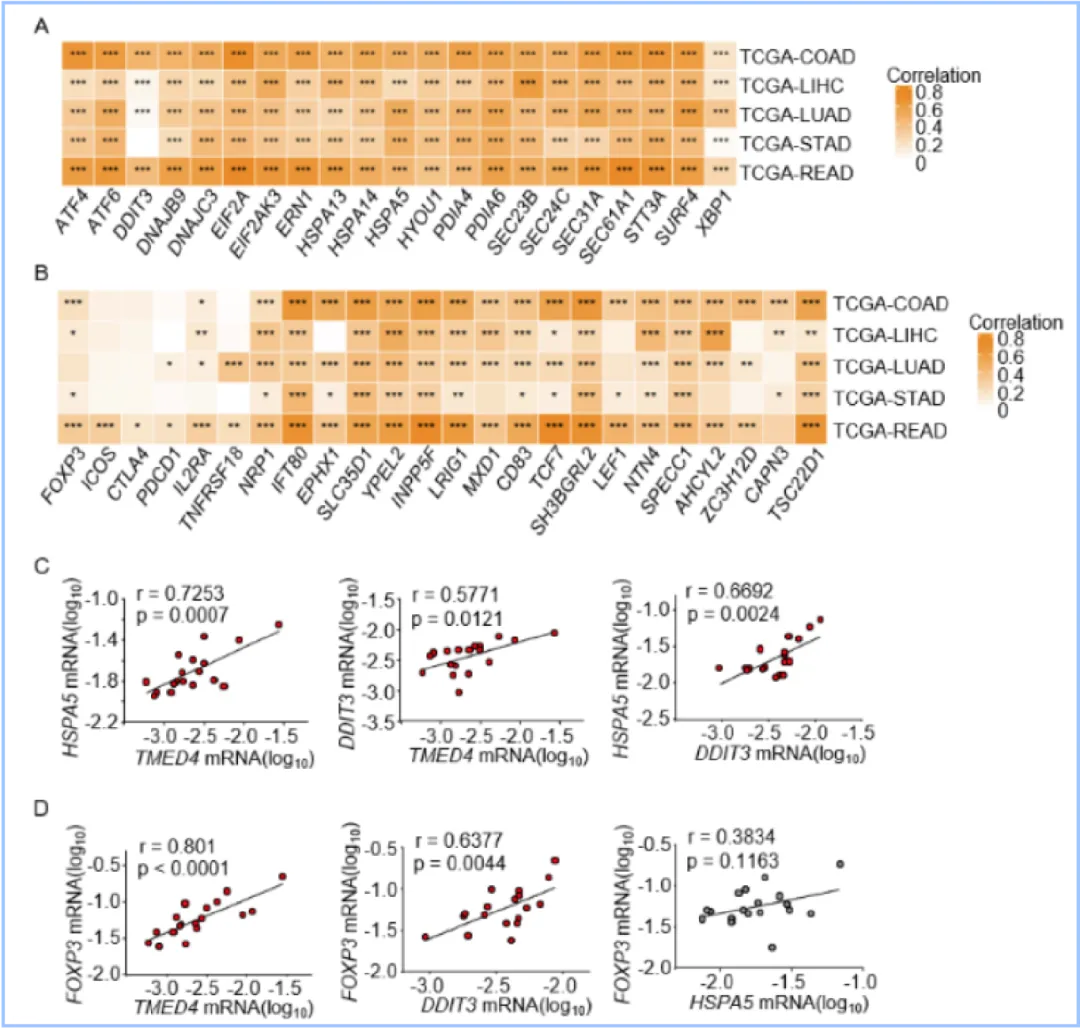
圖1.在人的多種腫瘤中,TMED4與腫瘤浸潤Treg細(xì)胞ERS相關(guān)基因和FOXP3表達(dá)呈正相關(guān)
本研究對(duì)癌癥基因組圖譜(TCGA)的多種癌癥數(shù)據(jù)集(結(jié)腸癌(COAD)、直腸癌(READ)、肺腺癌(LUAD)、肝癌(LIHC)和胃癌(STAD))基因表達(dá)譜進(jìn)行的相關(guān)性分析,揭示了ERS相關(guān)基因的表達(dá)譜以及Treg標(biāo)志基因的表達(dá)譜與TMED4之間存在很強(qiáng)的正相關(guān)性。此外,對(duì)人類結(jié)直腸癌、胃癌和腎癌樣本中分選出的CD4+CD25highTreg 細(xì)胞進(jìn)行的mRNA表達(dá)相關(guān)性分析結(jié)果進(jìn)一步發(fā)現(xiàn),TMED4的表達(dá)與腫瘤浸潤Treg細(xì)胞的ERS激活相關(guān)基因和FOXP3表達(dá)高度正相關(guān)(圖1)。
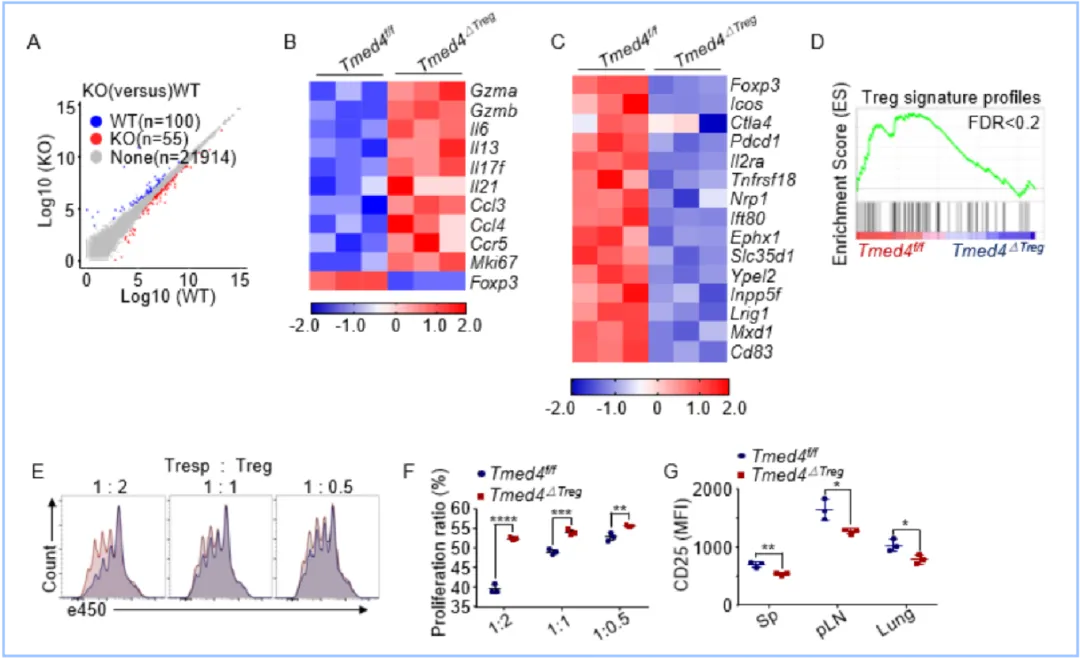
圖2. Tmed4缺失以細(xì)胞內(nèi)在的方式下調(diào)Treg細(xì)胞的特征圖譜和其體外抑制功能
為進(jìn)一步探討TMED4通過ERS參與調(diào)控Treg細(xì)胞功能的機(jī)制,作者通過對(duì)比野生型和Tmed4在Treg中特異性敲除小鼠(Tmed4ΔTreg)的表型,發(fā)現(xiàn)Tmed4ΔTreg小鼠相比于野生型小鼠表現(xiàn)出脾臟腫大、體重下降以及非淋巴器官淋巴細(xì)胞浸潤增加等自身炎癥表型,流式分析顯示Tmed4ΔTreg小鼠淋巴器官中T細(xì)胞高度活化且分泌更多的炎癥因子IFN-γ和IL-17。此外,本研究通過RNA-seq、體外抑制實(shí)驗(yàn)、骨髓過繼轉(zhuǎn)移模型(Bone marrow chimera)和嵌合體雌性小鼠模型(Female Chimera)等綜合驗(yàn)證了TMED4以細(xì)胞內(nèi)在的方式在維持Treg細(xì)胞Foxp3以及其他重要Treg表征分子的穩(wěn)定表達(dá)和正常抑制功能中發(fā)揮著重要作用。為探究Tmed4缺失對(duì)Treg細(xì)胞在體內(nèi)對(duì)病理生理的影響,本研究利用實(shí)驗(yàn)性自身免疫性腦脊髓炎小鼠模型(EAE)、T細(xì)胞誘導(dǎo)的慢性腸炎模型(T cell-induced chronic colitis)以及MC38皮下瘤小鼠模型,揭示了Tmed4缺失會(huì)促進(jìn)效應(yīng)性T細(xì)胞,尤其是Th1和CD8+T細(xì)胞的活化,導(dǎo)致小鼠自身免疫性炎癥的惡化和促進(jìn)抗腫瘤免疫。

圖3. ROS清除劑或NRF2誘導(dǎo)劑可回補(bǔ)Foxp3的表達(dá)和Tmed4缺失的Treg細(xì)胞的抑制功能
研究團(tuán)隊(duì)進(jìn)一步發(fā)現(xiàn)Tmed4的缺失顯著下調(diào)IRE1α蛋白水平及其下游XBP1信號(hào)通路。Seahorse實(shí)驗(yàn)揭示了Tmed4缺失導(dǎo)致Treg細(xì)胞線粒體受損,使其更依賴于糖酵解途徑而非氧化磷酸化,胞內(nèi)總體ROS及線粒體ROS水平明顯上調(diào)。通過ROS清除劑NAC以及NRF2誘導(dǎo)劑均能夠在體內(nèi)外有效回補(bǔ)Treg細(xì)胞Foxp3的表達(dá)和抑制功能(圖3)。此外,本研究還通過Ern1ΔTreg(Treg中特異性缺失IRE1α)小鼠、IRE1α 通路抑制劑(4μ8C和KIRA6)處理、IRE1α 蛋白回補(bǔ)(Sindbis病毒過表達(dá))以及PERK通路抑制(siRNA抑制PERK表達(dá))等方法揭示了TMED4特異性通過IRE1α-XBP1信號(hào)軸調(diào)控Treg細(xì)胞Foxp3表達(dá)和抑制功能的機(jī)制。
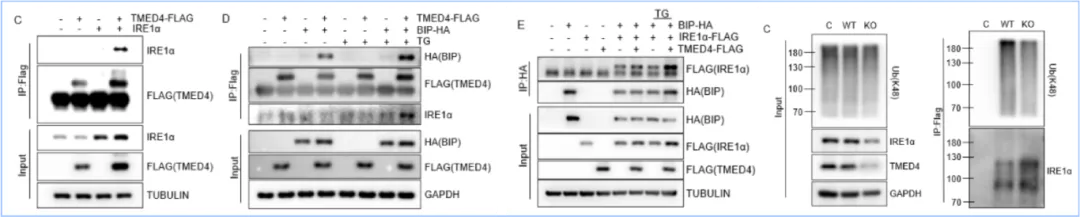
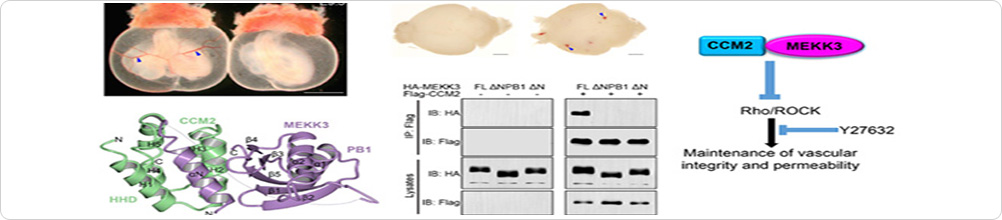
圖4. TMED4抑制HRD1/BIP介導(dǎo)的IRE1α降解
由于IRE1α蛋白水平的下調(diào)是TMED4缺失的Treg細(xì)胞功能受損的主要原因,本研究驗(yàn)證了TMED4促進(jìn)IRE1α、HRD1(ERAD復(fù)合物組分)及BIP結(jié)合。TMED4通過抑制ERAD介導(dǎo)的IRE1α蛋白的K48泛素化降解,進(jìn)而維持IRE1α 蛋白水平(圖4)。
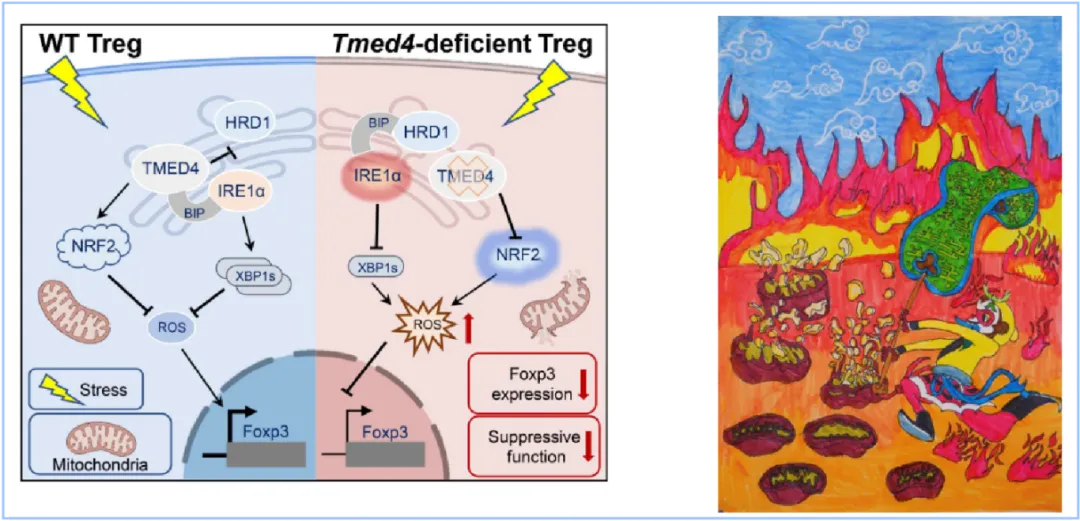
圖5. 圖文摘要(左)及封面圖構(gòu)思(右):TMED4在Treg中維持ER應(yīng)激反應(yīng)和線粒體活性以避免細(xì)胞ROS過度積累導(dǎo)致Foxp3表達(dá)和細(xì)胞抑制功能受損(左);取《西游記》孫悟空師徒過火焰山之意,孫悟空三借芭蕉扇(內(nèi)質(zhì)網(wǎng))撲滅火焰山火(損壞的線粒體產(chǎn)生的活性氧)(右)。
綜上,本研究揭示了TMED4在平衡ER應(yīng)激反應(yīng)和ROS中所起的作用(圖5),揭示靶向TMED4調(diào)控的Treg細(xì)胞抑制功能可以作為自身免疫性疾病和抗腫瘤免疫的有效策略。
上海市免疫學(xué)研究所吳學(xué)鋒組直博生蔣真言、王會(huì)子,李斌組博士后王曉霞和重慶師范大學(xué)郝友進(jìn)組研究生朵泓睿為本文的共同第一作者,吳學(xué)鋒研究員、李斌研究員以及郝友進(jìn)教授為共同通訊作者。該工作得到了免疫所蘇冰教授,上海交通大學(xué)醫(yī)學(xué)院附屬瑞金醫(yī)院消化內(nèi)科王正廷副主任醫(yī)師,武漢大學(xué)生命科學(xué)學(xué)院劉勇教授,上海交通大學(xué)基礎(chǔ)醫(yī)學(xué)院侯照遠(yuǎn)研究員和張鵬研究員等大力支持。該研究得到國家重點(diǎn)研發(fā)計(jì)劃、國家自然科學(xué)基金、上海市科委等基金項(xiàng)目資助,以及上海交通大學(xué)基礎(chǔ)醫(yī)學(xué)院和上海市免疫學(xué)研究所公共技術(shù)平臺(tái)和行政管理部門的支持。
文章鏈接:https://www.jci.org/articles/view/179874
[ 吳學(xué)鋒課題組近年發(fā)表文章 ]
1. Jiang Z, # Wang H, #Wang X, # Duo H, # Tao Y, Li J, Li X, Liu J, Ni J, Wu EJ, Xiang H, Guan C, Wang X, Zhang K, Zhang P, Hou Z, Liu Y, Wang Z, Su B, Li B, Hao Y*, Li B*, Wu X*. TMED4 facilitates Treg suppressive function via ROS homeostasis in tumor and autoimmune mouse models. J Clin Invest. 2024 Oct 31:e179874. (In press)
2. Tao Y, Jiang Z, Wang H, Li J, Li X, Ni J, Liu J, Xiang H, Guan C, Cao W, Li D, He K, Wang L, Hu J, Jin Y, Liao B*, Zhang T*, and Wu X*. Pseudokinase STK40 promotes Th1 and Th17 cell differentiation by targeting FOXO transcription factors. Sci Adv. (In press)
3. Wen Z, Yuan T, Liu J, Wang D, Ni J, Yan X, Tang J*, Tang J*, Wu X*, Wang Z*. Atg16l2 augments Nlrc4 inflammasome activation by facilitating NAIPs-NLRC4 association. Eur J Immunol. 2024 Aug 22:e2451078. doi: 10.1002/eji.202451078. PMID: 39175123.
4. Li Z,# Zhao J, # Wu Y, # Fan S, # Yuan H, Xia J, Hu L, Yang J, Liu J, Wu X*, Lin R*, Yang L*. TRAF2 decrease promotes the TGF-β-mTORC1 signal in MAFLD-HCC through enhancing AXIN1-mediated Smad7 degradation. FASEB J. 2024 Feb 29;38(4):e23491.PMID: 38363556.
5. Cao W, # Liu J,# Jiang Z, Tao Y, Wang H, Li J, Ni J,* and Wu X*. Tumor suppressor Adenomatous Polyposis Coli sustains dendritic cell tolerance through IL-10 in a β-catenin dependent manner. Journal of Immunology. 2023 Mar 31: ji2300046. doi: 10.4049/jimmunol.2300046. PMID: 37000474
6. Xiang H, Tao Y, Jiang Z, Huang X, Wang H, Cao W, Li J, Ding R, Shen M, Feng R, Li L, Guan C, Liu J, Ni J, Chen L, Wang Z, Ye Y, Zhong Q, Liu J, * Zou Q, * Wu X*. Vps33B controls Treg cell suppressive function through inhibiting lysosomal nutrient sensing complex-mediated mTORC1 activation. Cell Rep. 2022 Jun 14; 39(11):110943. doi: 10.1016/j.celrep.2022.110943. PMID: 35705052
7. Wang D#, Yuan T#, Liu J#, Wen Z, Shen Y, Tang J, Wang Z*, Wu X*. ATG16L2 inhibits NLRP3 inflammasome activation through promoting ATG5-12-16L1 complex assembly and autophagy. Eur J Immunol. 2022 Apr 15. doi: 10.1002/eji.202149764. PMID: 35426127
8. Kim MC#, Borcherding N#, Ahmed KK#, Voigt AP#, Vishwakarma A, Kolb R, Kluz PN, Pandey G, De U, Drashansky T, Helm EY, Zhang X, Gibson-Corley KN, Klesney-Tait J, Zhu Y, Lu J, Lu J, Huang X, Xiang H, Cheng J, Wang D, Wang Z, Tang J, Hu J, Wang Z, Liu H, Li M, Zhuang H, Avram D, Zhou D, Bacher R, Zheng SG, Wu X*, Zakharia Y*, Zhang W*. CD177 modulates the function and homeostasis of tumor-infiltrating regulatory T cells. Nat Commun. 2021; 12(1):5764. PMID: 34599187
9. Ni J, Guan C, Liu H, Huang X, Yue J, Xiang H, Jiang Z, Tao Y, Cao W, Liu J, Wang Z, Wang Y*, Wu X*. Ubc13 promotes K63-linked poly-ubiquitination of NLRP3 to activate inflammasome. Journal of Immunology 2021; 206(10):2376-2385. PMID: 33893171
10.Guan C, Huang X, Yue J, Xiang H, Shaheen S, Jiang Z, Tao Y, Tu J, Liu Z, Yao Y, Yang W, Hou Z, Liu J, Yang XD, Zou Q, Su B, Liu Z, Ni J*, Cheng J*, Wu X*. SIRT3-mediated deacetylation of NLRC4 promotes inflammasome activation. Theranostics 2021; 11(8):3981-3995. PMID: 33664876
 滬公網(wǎng)安備 31009102000053號(hào) 滬ICP備18007527號(hào)-1 郵箱:[email protected]
滬公網(wǎng)安備 31009102000053號(hào) 滬ICP備18007527號(hào)-1 郵箱:[email protected]