據(jù)統(tǒng)計,全球約有7.6%~9.4%的人群患有各種類型的自身免疫性疾病。自身免疫性疾病難以治愈,一旦患病,大多數(shù)患者需要長期甚至終身服藥,且部分疾病 (如狼瘡腎病)病情兇險,嚴重影響患者生活質(zhì)量,威脅患者生命安全。自身免疫病已經(jīng)成為除心血管疾病和癌癥外第三大慢性病。我國自身免疫性疾病發(fā)病人數(shù)約8000萬人,患者基數(shù)龐大,且患者人群在逐年增加。
自身免疫性疾病的一個重要驅(qū)動因素是T細胞的過度激活或分化失衡,例如CD4+T細胞趨向促炎的Th1/Th17細胞分化或Treg細胞抑制功能受損,然而T細胞如何調(diào)控自身免疫性疾病仍需要深入研究。吳學(xué)鋒團隊聚焦自身免疫性疾病中T細胞的功能和機制,尤其是細胞器穩(wěn)態(tài)和應(yīng)激反應(yīng)對Treg細胞的功能調(diào)控,近年來取得一系列研究成果:發(fā)現(xiàn)并鑒定Treg細胞異質(zhì)性的標志物CD177(Nature Communications,2021),揭示在內(nèi)吞過程中晚期內(nèi)體和溶酶體的融合(Cell Reports, 2022)及內(nèi)質(zhì)網(wǎng)應(yīng)激反應(yīng)通過活性氧ROS(Journal of Clinical Investigation, 2024)調(diào)控Treg細胞穩(wěn)態(tài)和抑制功能的機制。
CD4+輔助性T(T helper, Th)細胞分化的失調(diào)導(dǎo)致炎癥和自身免疫性疾病的發(fā)生,而調(diào)控Th細胞分化的分子網(wǎng)絡(luò)仍未被完全揭示。FOXO轉(zhuǎn)錄因子家族在Th1和Th17細胞分化中發(fā)揮至關(guān)重要的作用。假激酶是一類具有激酶同源結(jié)構(gòu)域但缺乏催化活性的蛋白。近期研究顯示,假激酶STK40作為支架蛋白協(xié)助E3泛素連接酶與底物蛋白結(jié)合從而促進蛋白的泛素化和降解,并在調(diào)控細胞分化中發(fā)揮重要作用。團隊前期研究發(fā)現(xiàn), STK40在T細胞經(jīng)抗CD3/CD28抗體刺激后表達上調(diào),提示STK40在活化的T細胞中發(fā)揮作用,而STK40是否及如何調(diào)控T細胞分化未知。
研究團隊利用條件性敲除小鼠,發(fā)現(xiàn)T細胞敲除STK40不影響T細胞穩(wěn)態(tài),但抑制Th1和Th17細胞體外分化。造模實驗顯示,T細胞中特異性STK40敲除小鼠的DSS誘導(dǎo)的急性腸炎和 T細胞介導(dǎo)的慢性腸炎癥狀顯著減輕,并對實驗性自身免疫性腦脊髓炎(Experimental autoimmune encephalomyelitis,EAE)更為抵抗。流式分析顯示,STK40敲除顯著降低結(jié)腸固有層(對腸炎模型)或中樞神經(jīng)系統(tǒng)(對EAE模型)中Th1和Th17細胞分化。研究團隊通過RNAseq發(fā)現(xiàn)STK40調(diào)控FOXO轉(zhuǎn)錄因子。研究團隊接著證明STK40通過促進E3泛素連接酶COP1與FOXO4結(jié)合,介導(dǎo)FOXO4蛋白K48鏈接泛素化及通過蛋白酶體降解。研究團隊發(fā)現(xiàn)敲除STK40的Th1細胞中FOXO4蛋白水平上調(diào),而抑制FOXO4可恢復(fù)STK40缺失導(dǎo)致的Th1細胞分化受損。此外,STK40則通過促進COP1介導(dǎo)的FOXO1蛋白K48鏈接泛素化和降解調(diào)控Th17細胞的分化。
綜上所述,這些研究闡明了STK40在Th1和Th17細胞分化中的關(guān)鍵調(diào)控作用,進一步完善了 Th1 和 Th17 細胞分化調(diào)控網(wǎng)絡(luò)的分子基礎(chǔ),有望為自身免疫疾病的治療提供有效的靶點。
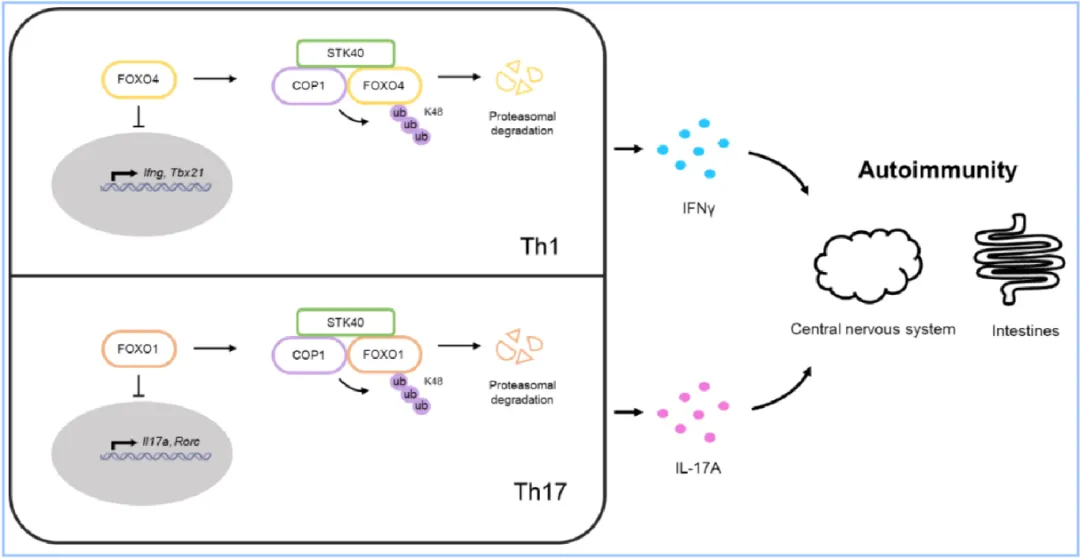
研究模式圖:STK40協(xié)助COP1介導(dǎo)的FOXO蛋白K48鏈接泛素化及降解,調(diào)控Th1和Th17細胞分化,促進炎癥和自身免疫性疾病進展。
上海交通大學(xué)醫(yī)學(xué)院上海市免疫學(xué)研究所2021級博士生(碩博)陶櫟簫是本研究論文的第一作者。上海交通大學(xué)醫(yī)學(xué)院上海市免疫學(xué)研究所吳學(xué)鋒研究員、上海交通大學(xué)醫(yī)學(xué)院附屬兒童醫(yī)院張婷主任醫(yī)師和上海交通大學(xué)基礎(chǔ)醫(yī)學(xué)院廖兵副研究員為共同通訊作者。上海交通大學(xué)基礎(chǔ)醫(yī)學(xué)院金穎教授提供大力支持。本研究得到國家重點研發(fā)計劃、國家自然科學(xué)基金、上海市科委項目、上海市地方高水平高校創(chuàng)新研究團隊項目和上海市細胞穩(wěn)態(tài)調(diào)節(jié)與人類疾病前沿科學(xué)中心,以及上海市免疫學(xué)研究所,上海交通大學(xué)基礎(chǔ)醫(yī)學(xué)院公共技術(shù)平臺和動物科學(xué)部的支持。
[ 吳學(xué)鋒課題組近年發(fā)表文章 ]
1. Jiang Z, # Wang H, #Wang X, # Duo H, # Tao Y, Li J, Li X, Liu J, Ni J, Wu EJ, Xiang H, Guan C, Wang X, Zhang K, Zhang P, Hou Z, Liu Y, Wang Z, Su B, Li B, Hao Y*, Li B*, Wu X*. TMED4 facilitates Treg suppressive function via ROS homeostasis in tumor and autoimmune mouse models. J Clin Invest. 2024 Oct 31:e179874. PMID: 39480507
2. Tao Y, Jiang Z, Wang H, Li J, Li X, Ni J, Liu J, Xiang H, Guan C, Cao W, Li D, He K, Wang L, Hu J, Jin Y, Liao B*, Zhang T*, and Wu X*. Pseudokinase STK40 promotes Th1 and Th17 cell differentiation by targeting FOXO transcription factors. Sci Adv. 2024 Nov 22;10(47):eadp2919. doi: 10.1126/sciadv.adp2919. Epub 2024 Nov 20. PMID: 39565845
3. Cao W, # Liu J,# Jiang Z, Tao Y, Wang H, Li J, Ni J,* and Wu X*. Tumor suppressor Adenomatous Polyposis Coli sustains dendritic cell tolerance through IL-10 in a β-catenin dependent manner. Journal of Immunology. 2023 Mar 31: ji2300046. doi: 10.4049/jimmunol.2300046. PMID: 37000474
4. Xiang H, Tao Y, Jiang Z, Huang X, Wang H, Cao W, Li J, Ding R, Shen M, Feng R, Li L, Guan C, Liu J, Ni J, Chen L, Wang Z, Ye Y, Zhong Q, Liu J, * Zou Q, * Wu X*. Vps33B controls Treg cell suppressive function through inhibiting lysosomal nutrient sensing complex-mediated mTORC1 activation. Cell Rep. 2022 Jun 14; 39(11):110943. doi: 10.1016/j.celrep.2022.110943. PMID: 35705052
5. Kim MC#, Borcherding N#, Ahmed KK#, Voigt AP#, Vishwakarma A, Kolb R, Kluz PN, Pandey G, De U, Drashansky T, Helm EY, Zhang X, Gibson-Corley KN, Klesney-Tait J, Zhu Y, Lu J, Lu J, Huang X, Xiang H, Cheng J, Wang D, Wang Z, Tang J, Hu J, Wang Z, Liu H, Li M, Zhuang H, Avram D, Zhou D, Bacher R, Zheng SG, Wu X*, Zakharia Y*, Zhang W*. CD177 modulates the function and homeostasis of tumor-infiltrating regulatory T cells. Nat Commun. 2021; 12(1):5764. PMID: 34599187
 滬公網(wǎng)安備 31009102000053號 滬ICP備18007527號-1 郵箱:[email protected]
滬公網(wǎng)安備 31009102000053號 滬ICP備18007527號-1 郵箱:[email protected] 滬公網(wǎng)安備 31009102000053號 滬ICP備18007527號-1 郵箱:[email protected]
滬公網(wǎng)安備 31009102000053號 滬ICP備18007527號-1 郵箱:[email protected]