


胰腺星狀細胞(PSCs)是胰腺癌腫瘤微環(huán)境(TME)中的關鍵組分,占基質成分的50%以上。在正常生理狀態(tài)下,靜息型PSCs維持著胰腺的正常結構和外分泌功能。然而,在胰腺癌等病理條件下,PSCs會被激活,進而過度分泌膠原蛋白,破壞細胞外基質(ECM)的動態(tài)平衡。同時,作為腫瘤組織生長因子的主要來源,激活的PSCs還顯著促進腫瘤細胞的增殖、侵襲和耐藥性1。值得注意的是,現(xiàn)有研究多將激活的PSCs視為均質群體進行研究,忽視了其內在的細胞異質性,這使得相關研究成果在臨床轉化中面臨局限性2-3。因此,系統(tǒng)闡明PSCs在胰腺癌TME中的激活調控機制、細胞異質性特征及其與TME其他組分的相互作用,對于開發(fā)新型胰腺癌靶向治療策略具有重要意義。
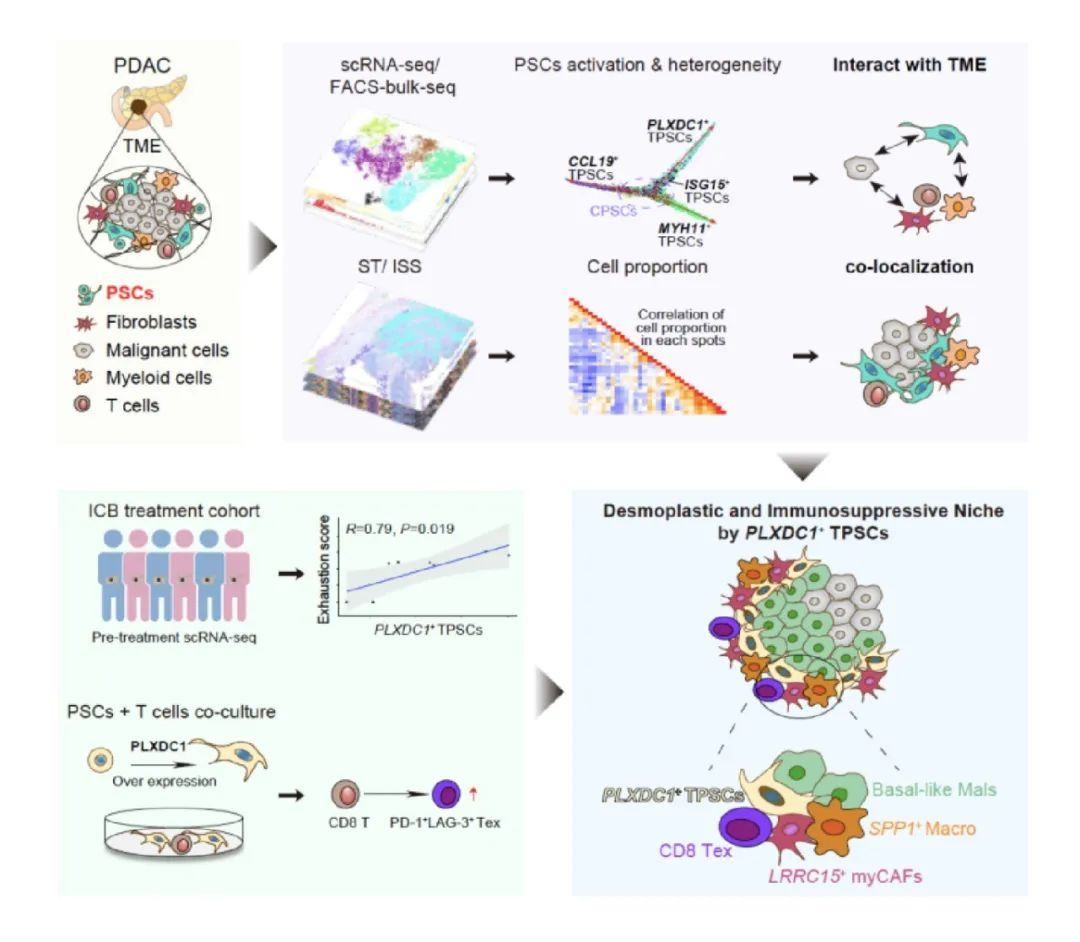
為深入解析PSCs在胰腺癌發(fā)生發(fā)展中的作用,研究團隊創(chuàng)新性地整合了流式分選PSCs的轉錄組和表觀基因組數(shù)據(jù)、單細胞與空間轉錄組數(shù)據(jù)以及原位測序等多組學數(shù)據(jù),系統(tǒng)比較了癌旁/正常組織與胰腺癌組織中PSCs的組成特征。研究首次揭示了PSCs從靜息到激活轉變的關鍵調控因子,并成功鑒定了四種具有不同功能的腫瘤相關胰腺星狀細胞(TPSCs)亞群。研究發(fā)現(xiàn),壓力與低氧信號通過調控轉錄組和表觀遺傳重塑,驅動了PSCs在胰腺癌中的激活。激活后的PSCs可進一步分化為三種主要亞群:(1)炎癥相關的CCL19+ TPSCs,主要富集于免疫細胞密集區(qū);(2)具有平滑肌細胞特征的 MYH11+ TPSCs,主要定位于非惡性基質區(qū)域;(3)具有向癌癥相關成纖維細胞(myCAFs)分化潛能的PLXDC1+ TPSCs,主要分布于惡性腫瘤細胞邊界的基質區(qū)域,且與患者不良預后顯著相關。
特別值得注意的是,研究發(fā)現(xiàn)PLXDC1+ TPSCs與侵襲性LRRC15+ myCAFs和SPP1+巨噬細胞在腫瘤邊界形成緊密的空間共定位,通過復雜的相互作用共同構建了纖維化和免疫抑制微環(huán)境,導致CD8+ T細胞的耗竭與排斥。通過體外共培養(yǎng)實驗,研究進一步證實了PLXDC1+ TPSCs具有誘導CD8+ T細胞耗竭的能力。此外,通過對接受免疫檢查點抑制治療(ICB)的胰腺癌患者單細胞轉錄組數(shù)據(jù)的深入分析,研究揭示了PLXDC1+ TPSCs與T細胞耗竭正相關,并在臨床隊列中驗證了PLXDC1+ TPSCs與免疫治療療效不佳的顯著關聯(lián)。
本研究首次在單細胞和空間維度上系統(tǒng)解析了胰腺癌中PSCs的異質性特征及其功能調控網絡,不僅為深入理解PSCs在胰腺癌發(fā)生發(fā)展中的作用機制提供了新的見解,更為開發(fā)基于靶向腫瘤邊界富集的PLXDC1+ TPSCs的新型靶向治療策略奠定了重要的理論基礎。研究提出的靶向PSCs的治療策略,有望為改善胰腺癌患者的治療效果提供新的思路。
上海交通大學醫(yī)學院上海市免疫學研究所杜艷華副研究員、上海交通大學醫(yī)學院附屬瑞金醫(yī)院博士研究生趙一舟和海軍軍醫(yī)大學附屬長征醫(yī)院李居東博士為文章的共同一作,上海交通大學醫(yī)學院上海市免疫學研究所葉幼瓊研究員、上海交通大學醫(yī)學院附屬瑞金醫(yī)院鄒多武教授、海軍軍醫(yī)大學附屬長征醫(yī)院邵成浩教授和河北大學附屬醫(yī)院程樹杰教授為文章的共同通訊作者。該工作得到了上海市免疫學研究所李斌教授的大力支持。該研究得到了國家自然科學基金、上海市自然科學基金和上海交通大學“2030”計劃等項目資助,以及上海市免疫學研究所成像、測序等平臺的技術支持。
[ 參考文獻 ]
1. Sherman MH. Stellate Cells in Tissue Repair, Inflammation, and Cancer. Annu Rev Cell Dev Biol 2018; 34:333–355.
2 Schnittert J, Bansal R, Prakash J. Targeting Pancreatic Stellate Cells in Cancer. Trends Cancer 2019;5:128–142.
3. Helms EJ, Berry MW, Chaw RC, et al. Mesenchymal Lineage Heterogeneity Underlies Nonredundant Functions of Pancreatic Cancer–Associated Fibroblasts. Cancer Discov 2022; 12:484–501.

 滬公網安備 31009102000053號 滬ICP備18007527號-1 郵箱:[email protected]
滬公網安備 31009102000053號 滬ICP備18007527號-1 郵箱:[email protected] 滬公網安備 31009102000053號 滬ICP備18007527號-1 郵箱:[email protected]
滬公網安備 31009102000053號 滬ICP備18007527號-1 郵箱:[email protected]