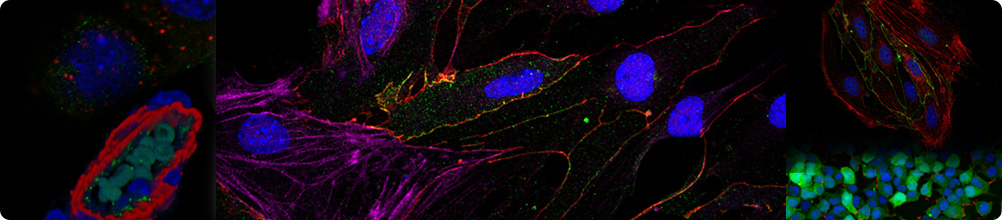
氧化應(yīng)激是惡性腫瘤的典型特征,癌細(xì)胞通過激活谷胱甘肽(GSH)合成通路維持還原狀態(tài)以清除過量ROS1。xc?系統(tǒng)(由SLC7A11和SLC3A2組成的異源二聚體轉(zhuǎn)運(yùn)復(fù)合物)是GSH合成的關(guān)鍵調(diào)控系統(tǒng),其中SLC7A11介導(dǎo)的胱氨酸攝取對(duì)維持GSH合成至關(guān)重要,抑制SLC7A11可誘導(dǎo)腫瘤細(xì)胞鐵死亡2。最新研究發(fā)現(xiàn),葡萄糖剝奪時(shí),SLC7A11過表達(dá)會(huì)導(dǎo)致二硫化物累積,進(jìn)而觸發(fā)一種新型細(xì)胞死亡方式—雙硫死亡3。這表明SLC7A11具有調(diào)控氧化還原穩(wěn)態(tài)和程序性死亡的雙重功能,但其在腫瘤微環(huán)境(TME)中的免疫調(diào)節(jié)作用仍有待深入闡明。
CD8+ T細(xì)胞作為抗腫瘤免疫的核心效應(yīng)細(xì)胞,在TME中因持續(xù)抗原刺激而呈現(xiàn)耗竭表型4。TME中的多種代謝應(yīng)激通過不同機(jī)制抑制CD8+ T細(xì)胞功能:缺氧通過誘導(dǎo)線粒體功能障礙促進(jìn)T細(xì)胞耗竭5;乳酸積累抑制CD8+ T細(xì)胞的增殖和效應(yīng)功能6;CD36介導(dǎo)的脂肪酸攝取引發(fā)脂質(zhì)過氧化和鐵死亡7,進(jìn)而削弱其抗腫瘤能力。然而,TME中的雙硫死亡介導(dǎo)的二硫鍵應(yīng)激對(duì)CD8+ T細(xì)胞抗腫瘤功能的作用機(jī)制亟待研究。
研究團(tuán)隊(duì)通過整合多組學(xué)數(shù)據(jù)、臨床癌癥患者標(biāo)本及小鼠移植瘤模型等,發(fā)現(xiàn)腫瘤浸潤(rùn)耗竭CD8+ T細(xì)胞的雙硫死亡水平顯著上調(diào);通過遺傳學(xué)手段限制胱氨酸的攝取可顯著降低腫瘤浸潤(rùn)C(jī)D8+ T細(xì)胞的雙硫死亡水平,并有效改善其耗竭狀態(tài),從而提高其抗腫瘤免疫應(yīng)答水平;利用條件性基因敲除小鼠證實(shí),G6PD活性缺失導(dǎo)致NADPH生成障礙,進(jìn)而促進(jìn)雙硫死亡;通過蛋白質(zhì)組學(xué)篩選結(jié)合免疫共沉淀驗(yàn)證,鑒定LDHB與G6PD直接結(jié)合,進(jìn)而抑制G6PD二聚體形成并降低其催化活性,從而促進(jìn)CD8+ T細(xì)胞的雙硫死亡;遺傳學(xué)干預(yù)實(shí)驗(yàn)證實(shí),特異性干預(yù)LDHB可有效逆轉(zhuǎn)CD8+ T細(xì)胞的雙硫死亡及耗竭水平;機(jī)制研究發(fā)現(xiàn),腫瘤浸潤(rùn)耗竭CD8+ T細(xì)胞中轉(zhuǎn)錄因子STAT3可促進(jìn)LDHB表達(dá),以介導(dǎo)LDHB-G6PD相互作用并限制G6PD活性。本研究首次闡明STAT3-LDHB-G6PD信號(hào)軸在調(diào)控CD8+ T細(xì)胞雙硫死亡及耗竭中的重要作用,為開發(fā)基于靶向干預(yù)LDHB的腫瘤免疫治療新策略提供了重要理論依據(jù)。

上海交通大學(xué)醫(yī)學(xué)院上海市免疫學(xué)研究所博士后萬杰、河北大學(xué)附屬醫(yī)院史建紅、上海交通大學(xué)醫(yī)學(xué)院附屬同仁醫(yī)院施敏和上海交通大學(xué)醫(yī)學(xué)院附屬瑞金醫(yī)院黃海燕為文章的共同第一作者。上海交通大學(xué)醫(yī)學(xué)院上海市免疫學(xué)研究所鄒強(qiáng)、河北大學(xué)附屬醫(yī)院李靖華、山東中醫(yī)藥大學(xué)李霞和上海交通大學(xué)醫(yī)學(xué)院附屬新華醫(yī)院崔心剛為文章的共同通訊作者。該研究得到國(guó)家自然科學(xué)基金杰青、重點(diǎn)項(xiàng)目支持。
[ 參考文獻(xiàn) ]
1. Hayes, J. D., Dinkova-Kostova, A. T. & Tew, K. D. Oxidative Stress in Cancer. Cancer Cell 38, 167-197, doi:10.1016/j.ccell.2020.06.001 (2020).
2. Liu, X., Zhuang, L. & Gan, B. Disulfidptosis: disulfide stress-induced cell death. Trends Cell Biol 34, 327-337, doi:10.1016/j.tcb.2023.07.009 (2024).
3. Liu, X. et al. Actin cytoskeleton vulnerability to disulfide stress mediates disulfidptosis. Nat Cell Biol 25, 404-414, doi:10.1038/s41556-023-01091-2 (2023).
4. Philip, M. & Schietinger, A. CD8(+) T cell differentiation and dysfunction in cancer. Nat Rev Immunol 22, 209-223, doi:10.1038/s41577-021-00574-3 (2022).
5. Scharping, N. E. et al. Mitochondrial stress induced by continuous stimulation under hypoxia rapidly drives T cell exhaustion. Nat Immunol 22, 205-215, doi:10.1038/s41590-020-00834-9 (2021).
6. Quinn, W. J., 3rd et al. Lactate Limits T Cell Proliferation via the NAD(H) Redox State. Cell Rep 33, 108500, doi:10.1016/j.celrep.2020.108500 (2020).
7. Xu, S. et al. Uptake of oxidized lipids by the scavenger receptor CD36 promotes lipid peroxidation and dysfunction in CD8(+) T cells in tumors. Immunity 54, 1561-1577 e1567, doi:10.1016/j.immuni.2021.05.003 (2021).

鄒強(qiáng),上海交通大學(xué)醫(yī)學(xué)院上海市免疫學(xué)研究所研究員,資深課題組長(zhǎng),課題組聚焦腫瘤免疫代謝,從機(jī)體宏環(huán)境和腫瘤微環(huán)境兩個(gè)層面,解析腫瘤免疫應(yīng)答與耐受的代謝調(diào)控機(jī)制,探索干預(yù)腫瘤免疫代謝提高腫瘤免疫應(yīng)答的免疫治療策略,已取得了多項(xiàng)重要學(xué)術(shù)成果,以通訊作者在Immunity、Nature Cell Biology、Cell Metabolism、Molecular Cell等學(xué)術(shù)期刊發(fā)表多篇論文。誠(chéng)邀有志于腫瘤免疫代謝研究的青年才俊加盟,課題組將為優(yōu)秀博士后的發(fā)展提供一流的科研條件與全方位的支持。
 滬公網(wǎng)安備 31009102000053號(hào) 滬ICP備18007527號(hào)-1 郵箱:[email protected]
滬公網(wǎng)安備 31009102000053號(hào) 滬ICP備18007527號(hào)-1 郵箱:[email protected]