近日,著名學(xué)術(shù)期刊Advanced Materials(影響因子32.1)在線發(fā)表了公共衛(wèi)生學(xué)院宋海云研究員與季曉媛副研究員、上海交通大學(xué)化學(xué)化工學(xué)院樊春海院士和上海師范大學(xué)化學(xué)與材料科學(xué)院陳楠教授團(tuán)隊(duì)題為“Slimming and Reinvigorating Tumor-Associated Dendritic Cells with Hierarchical Lipid Rewiring Nanoparticles”的研究成果。該研究設(shè)計(jì)和構(gòu)建了一種多層次脂質(zhì)重編程納米粒子,特異性地向腫瘤相關(guān)樹突狀細(xì)胞遞送多種脂代謝干預(yù)藥物,通過協(xié)同性地抑制外源性脂質(zhì)攝取、內(nèi)源性脂質(zhì)合成和成脂基因轉(zhuǎn)錄等途徑重塑腫瘤相關(guān)樹突狀細(xì)胞的抗腫瘤免疫功能,從而提出了一種重塑腫瘤浸潤免疫細(xì)胞的新策略,顯著提高了癌癥免疫治療效果。
腫瘤相關(guān)樹突狀細(xì)胞(TADCs)是抗腫瘤先天性免疫和適應(yīng)性免疫的關(guān)鍵免疫細(xì)胞,然而外源性脂質(zhì)攝取和內(nèi)源性脂質(zhì)合成的多途徑脂質(zhì)代謝機(jī)制可誘導(dǎo)TADCs產(chǎn)生免疫耐受,從而降低腫瘤對多種治療策略的響應(yīng)性。該研究利用聚己內(nèi)酯-聚乙烯亞胺納米粒子(PCL-PEI)的自組裝特性,在疏水性內(nèi)核中負(fù)載乙酰輔酶A羧化酶抑制劑(TOFA)和X-框結(jié)合蛋白mRNA剪切抑制劑(STF),并在親水的納米粒子表面通過靜電作用裝載脂質(zhì)攝取抑制劑Fucoidan,構(gòu)建了一種多層次脂質(zhì)重編程納米粒子。該納米粒子表面包被的Fucoidan可以靶向TADCs表面的脂質(zhì)轉(zhuǎn)運(yùn)受體Msr1并同時(shí)抑制外源性脂質(zhì)攝取,而納米粒子內(nèi)化后釋放的TOFA和STF分別抑制內(nèi)源性脂質(zhì)生物合成和脂質(zhì)合成相關(guān)基因轉(zhuǎn)錄,三效合一重編程TADCs脂質(zhì)代謝,從而緩解TADCs的免疫耐受并重塑其在炎性細(xì)胞因子分泌、細(xì)胞毒性T細(xì)胞募集和腫瘤抑制等方面的功能,進(jìn)一步克服了腫瘤對免疫檢查點(diǎn)阻斷療法的耐藥性,為腫瘤免疫療法提供了一種非傳統(tǒng)模式的新方案(圖1)。
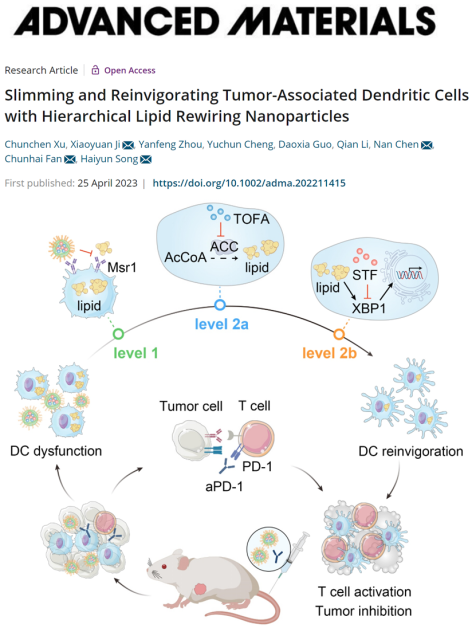
圖1 多層次脂質(zhì)重編程納米粒子抗腫瘤策略示意圖。圖片來源:Adv. Mater.
TADCs中的脂質(zhì)累積由多途徑的脂質(zhì)代謝異常介導(dǎo),是其失去抗腫瘤免疫功能的關(guān)鍵因素。首先,TADCs細(xì)胞表面高表達(dá)的脂質(zhì)轉(zhuǎn)運(yùn)受體Msr1促進(jìn)了細(xì)胞外源性脂質(zhì)攝取。其次,細(xì)胞質(zhì)中活躍的脂質(zhì)從頭生物合成過程維持了TADCs中高水平的甘油三酯(TAG)。此外,腫瘤微環(huán)境高氧化壓力的環(huán)境誘導(dǎo)TADCs中脂質(zhì)過氧化副產(chǎn)物的累積,觸發(fā)了內(nèi)質(zhì)網(wǎng)應(yīng)激反應(yīng)因子XBP1介導(dǎo)的脂質(zhì)合成基因的轉(zhuǎn)錄水平上調(diào),進(jìn)一步促進(jìn)了TADCs的脂質(zhì)合成。由于脂質(zhì)累積途徑的復(fù)雜性,對 TADCs進(jìn)行高效的脂代謝干預(yù)具有很大的挑戰(zhàn)性。在本研究中,包被Fucoidan的納米粒子特異性地靶向TADCs細(xì)胞膜表面受體Msr1并競爭性抑制外源性脂質(zhì)攝取,此外內(nèi)化的納米粒子可釋放TOFA和STF,分別抑制細(xì)胞質(zhì)脂質(zhì)從頭合成和細(xì)胞核脂質(zhì)合成相關(guān)基因轉(zhuǎn)錄,進(jìn)而降低TADCs內(nèi)源性脂質(zhì)合成,達(dá)到三效合一的脂質(zhì)干預(yù)效果。
在腫瘤微環(huán)境高脂質(zhì)豐度的長期刺激下,TADCs盡管保留了抗原吞噬能力,但其向T細(xì)胞呈遞抗原的能力大大受損,從而分化為耐受型表型(tolDCs),主要表現(xiàn)為細(xì)胞表面的共刺激分子(CD80、CD86和CD40)和抗原呈遞分子MHC表達(dá)水平下降,以及炎性細(xì)胞因子IL-12、IL-6、TNFα和IFNα等分泌減少。這不僅抑制了效應(yīng)T細(xì)胞的抗腫瘤免疫功能,而且促進(jìn)了腫瘤免疫抑制微環(huán)境的形成。在本研究中,脂質(zhì)重編程納米粒子通過靶向TADCs的多層次脂質(zhì)干預(yù),提高TADCs呈遞抗原和分泌炎性細(xì)胞因子的能力,進(jìn)而誘導(dǎo)細(xì)胞毒性T細(xì)胞增殖與激活(圖2)。
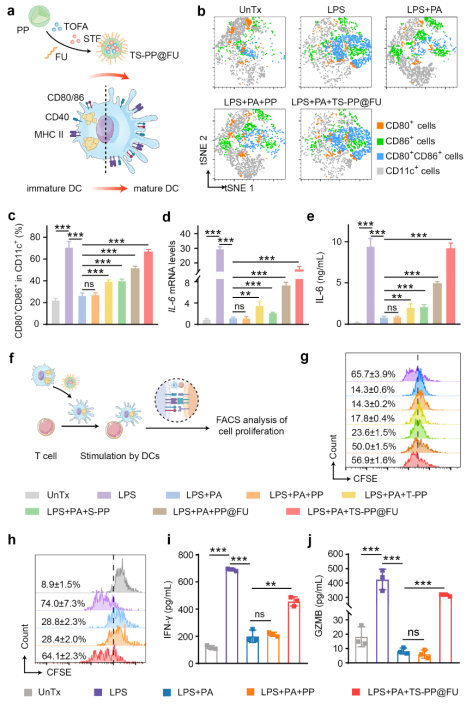
圖2 多層次脂質(zhì)代謝重編程納米粒子重塑TADCs。圖片來源:Adv. Mater.
在小鼠原位三陰性乳腺癌模型中,包被Fucoidan的納米粒子能夠更有效地富集于腫瘤部位并優(yōu)先被TADCs內(nèi)化,通過同時(shí)限制外源性脂質(zhì)攝取和內(nèi)源性脂質(zhì)合成,協(xié)同降低TADCs的脂質(zhì)豐度,從而逆轉(zhuǎn)TADCs的免疫耐受表型并增強(qiáng)TADCs對細(xì)胞毒性T細(xì)胞的募集能力和抗腫瘤功效。此外,鑒于三陰性乳腺癌對免疫檢查點(diǎn)抑制劑aPD-1的耐藥性,研究發(fā)現(xiàn)多層次脂質(zhì)重編程納米粒子可增強(qiáng)小鼠三陰性乳腺腫瘤對aPD-1的藥物敏感性并顯著延長小鼠生存時(shí)間。這項(xiàng)研究提出了一種借助脂代謝重編程實(shí)現(xiàn)免疫細(xì)胞瘦身和功能重塑的策略,為腫瘤的免疫療法提供了一種新思路和方法。
公共衛(wèi)生學(xué)院宋海云研究員與季曉媛副研究員、上海交通大學(xué)化學(xué)化工學(xué)院樊春海院士和上海師范大學(xué)化學(xué)與材料科學(xué)院陳楠教授為該文的共同通訊作者。上海交通大學(xué)碩士研究生徐春辰和副研究員季曉媛為該論文的并列第一作者。