近日,著名學(xué)術(shù)期刊《Advanced Materials》(影響因子32.1)在線發(fā)表了公共衛(wèi)生學(xué)院宋海云研究員、王慧教授、季曉媛副研究員和化學(xué)化工學(xué)院樊春海院士團(tuán)隊(duì)題為“Targeted Reprogramming of Vitamin B3 Metabolism as a Nanotherapeutic Strategy towards Chemoresistant Cancers”的研究成果。該研究利用腫瘤微環(huán)境響應(yīng)性水凝膠遞送平臺裝載雙子納米粒子,通過對腫瘤干細(xì)胞周圍的壁龕基質(zhì)腫瘤相關(guān)成纖維細(xì)胞的代謝重編程和表觀遺傳調(diào)控,阻斷腫瘤干細(xì)胞干性維持因子和免疫抑制性細(xì)胞招募因子的分泌,誘導(dǎo)腫瘤干細(xì)胞分化和免疫激活,提高乳腺癌、肝癌、胰腺癌和結(jié)直腸癌在內(nèi)的多種化療耐藥性腫瘤對一線化療藥物的響應(yīng)性,有效抑制腫瘤生長并誘導(dǎo)長期免疫記憶。宋海云課題組近年來聚焦于腫瘤耐藥的干預(yù),針對腫瘤干細(xì)胞擴(kuò)增和代謝異常等腫瘤微環(huán)境特征,通過設(shè)計(jì)新型生物材料,發(fā)展精準(zhǔn)的表觀遺傳干預(yù)和代謝干預(yù)技術(shù),增強(qiáng)腫瘤對化療和免疫療法的敏感性以及預(yù)防腫瘤的復(fù)發(fā)和轉(zhuǎn)移,2023年已有3項(xiàng)重要成果發(fā)表于《Advanced Materials》。
腫瘤相關(guān)成纖維細(xì)胞(CAFs)通過合成細(xì)胞外基質(zhì)蛋白,如I型膠原蛋白和纖黏蛋白等,在腫瘤干細(xì)胞周圍形成阻礙藥物進(jìn)入的屏障。更重要的是,CAFs通過分泌細(xì)胞因子誘導(dǎo)腫瘤干細(xì)胞富集,維持腫瘤干細(xì)胞干性,促進(jìn)腫瘤化療耐受;同時分泌多種趨化因子招募免疫抑制性細(xì)胞(MDSC和Treg),產(chǎn)生免疫抑制性微環(huán)境。在本研究中,水凝膠釋放的雙子納米粒子分別向CAFs遞送煙酰胺N-甲基轉(zhuǎn)移酶(NNMT)的干擾RNA和向腫瘤細(xì)胞遞送化療藥物。其中,裝載干擾RNA的納米粒子表面包被了CAF細(xì)胞膜,通過同源靶向效應(yīng)進(jìn)入CAFs并沉默CAFs中高表達(dá)的NNMT,抑制異常的VB3代謝,重塑染色質(zhì)的甲基化和去乙酰化修飾,進(jìn)而阻斷腫瘤干細(xì)胞干性維持因子和免疫抑制性細(xì)胞招募因子的表達(dá),誘導(dǎo)腫瘤干細(xì)胞分化和免疫激活;裝載化療藥物的納米粒子表面經(jīng)腫瘤細(xì)胞膜偽裝,可靶向和殺死已分化的腫瘤細(xì)胞。通過雙納米粒子的協(xié)同作用可實(shí)現(xiàn)腫瘤的完全消退(圖1)。
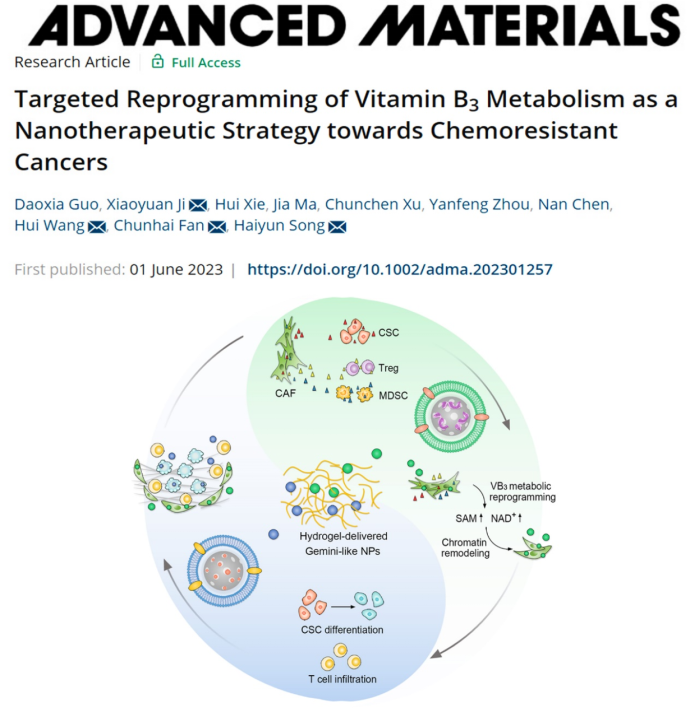
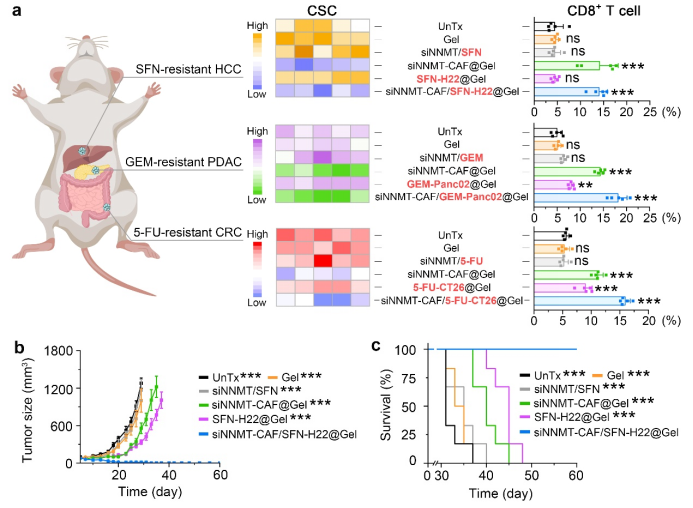
在化療耐藥性乳腺癌、肝癌、胰腺癌和結(jié)直腸癌小鼠模型中,水凝膠介導(dǎo)的雙靶向納米遞藥體系能夠顯著降低腫瘤干細(xì)胞和免疫抑制性細(xì)胞的豐度,增強(qiáng)殺傷性T細(xì)胞對腫瘤的浸潤,逆轉(zhuǎn)腫瘤對化療藥物的耐受性,避免腫瘤導(dǎo)致的死亡(圖2)。這項(xiàng)研究提供了一種具有廣譜適用性的、基于腫瘤基質(zhì)細(xì)胞VB3代謝重編程的化療耐藥性腫瘤治療策略。
公共衛(wèi)生學(xué)院宋海云研究員、王慧教授、季曉媛副研究員和上海交通大學(xué)化學(xué)化工學(xué)院樊春海院士為該文的共同通訊作者。上海交通大學(xué)博士研究生郭道霞和副研究員季曉媛為該論文的并列第一作者。