Cell Stem Cell | 我院李亞東的研究團隊發(fā)現(xiàn)改善AD記憶障礙新策略
阿爾茲海默病(AD)是一類以認知情感損害為主要行為表現(xiàn)的嚴重的神經(jīng)退行性疾病。通過調控成年海馬神經(jīng)發(fā)生(AHN)以改善AD認知情感損害一直是神經(jīng)科學家不斷探索的科學難題,但有效性尚存爭議。近日,北卡羅來納大學教堂山分校(UNC)宋娟課題組博士后李亞東(現(xiàn)為上海交通大學醫(yī)學院松江研究院研究員)、羅艷佳(共同第一作者,現(xiàn)為上海交通大學醫(yī)學院第九人民醫(yī)院研究員)等在調控成年海馬新生神經(jīng)元改善AD認知情感障礙方向取得重要研究進展,相關成果于4月6日以‘Activation of hypothalamic-enhanced adult-born neurons restores cognitive and affective function in Alzheimer's disease’為題在Cell Stem Cell以Article形式發(fā)表。

近年來,通過調控海馬神經(jīng)發(fā)生改善AD認知情感損害一直是研究熱點。2018年,哈佛醫(yī)學院Tanzi課題組通過對P7C3和Wnt3基因的操控成功拯救了AD小鼠受損的AHN,然而遺憾的是,單獨提高AHN不足以改善AD小鼠記憶障礙,只有結合BDNF和提高AHN兩種策略才能改善記憶(Choi, Science 2018)。有意思的是,Salta課題組報道,拯救miR-132基因能夠改善AD小鼠神經(jīng)發(fā)生,提高記憶能力(Walgrave, Cell Stem Cell 2021)。無獨有偶,隨后的報道顯示敲除Bax基因同樣增加AD小鼠海馬新生神經(jīng)元同樣改善記憶(Mishra,J Exp Med 2022)。這些結果提示,對AHN的不同的干預策略在拯救海馬新生神經(jīng)元改善記憶的效果上可能存在明顯差異;以上基因操控的方法對神經(jīng)發(fā)育的動態(tài)過程并不可控且機制不清。
不同于基因操控,靶向神經(jīng)環(huán)路可以實現(xiàn)對AHN不同階段的精準調控,增加海馬新生神經(jīng)元。李亞東博士等前期報道,促覺醒核團下丘腦乳頭上核(SuM)通過向海馬齒狀回釋放谷氨酸和GABA遞質,促進空間記憶提取(李亞東,eLife 2020)。有趣的是,刺激SuM環(huán)路明顯促進海馬神經(jīng)發(fā)生,增加海馬新生神經(jīng)元數(shù)量和成熟度,進一步使用化學遺傳學方法激活SuM環(huán)路調控的海馬新生神經(jīng)元,明顯改善小鼠記憶能力,對抗焦慮樣行為(李亞東、羅艷佳等,Nat Neurosci 2022)。據(jù)此,李亞東等提出多水平調控海馬神經(jīng)發(fā)生(新生神經(jīng)元數(shù)量、發(fā)育程度以及活性)改善記憶的新策略(李亞東、羅艷佳&宋娟,Curr Opin Neurobiol 2023)。
那么操控SuM環(huán)路能否改善AD小鼠的神經(jīng)發(fā)生呢?基于以上策略,研究人員首先通過刺激SuM增加海馬新生神經(jīng)元數(shù)量和成熟度。遺憾的是,盡管海馬新生神經(jīng)元數(shù)量增加,但是AD小鼠空間記憶和情感功能沒有明顯改變,提示通過環(huán)路操控的策略增加AD小鼠海馬新生神經(jīng)元數(shù)量不足以改善受損的額記憶和情感行為。
激活健康小鼠海馬新生神經(jīng)元提高記憶能力,于是研究人員嘗試激活AD小鼠海馬新生神經(jīng)元。然而,化學遺傳學方法興奮海馬新生神經(jīng)元同樣不足以改善AD小鼠記憶情感功能。這可能與AD小鼠的海馬神經(jīng)發(fā)生受損有關。
最后,研究人員通過多水平調控海馬新生神經(jīng)元,即在激活SuM環(huán)路增加海馬新生神經(jīng)元數(shù)量和發(fā)育度后,再通過化學遺傳學法興奮經(jīng)過SuM環(huán)路修飾的海馬新生神經(jīng)元,最終實現(xiàn)對AD小鼠空間記憶和情感功能的拯救(圖1)。
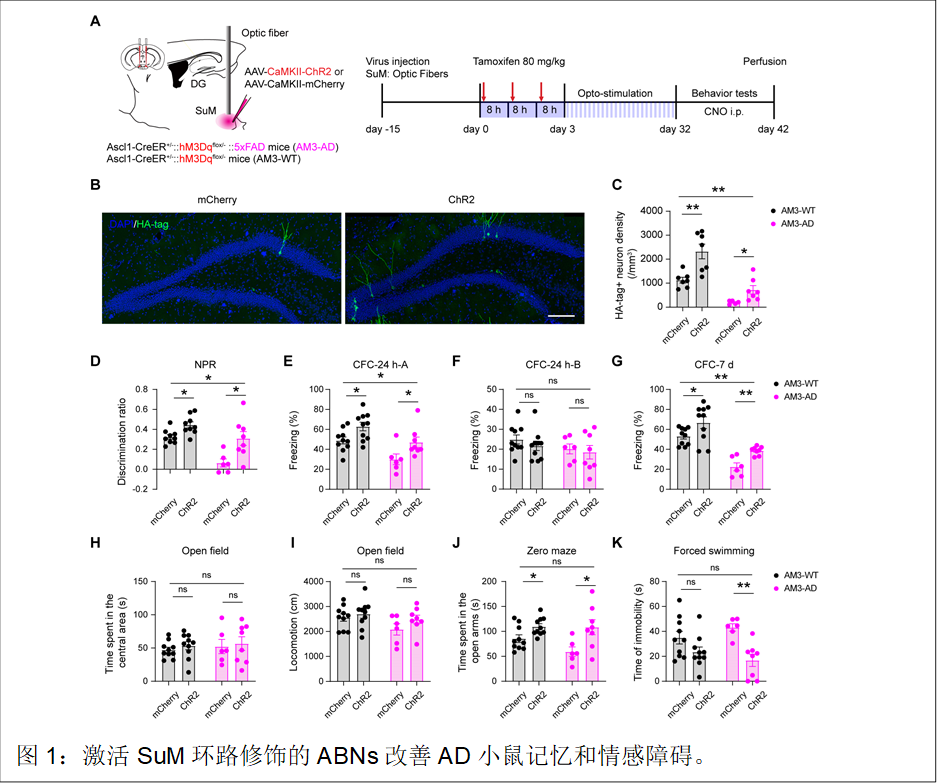
研究人員進一步探索激活SuM環(huán)路修飾的海馬新生神經(jīng)元改善記憶的機制。通過蛋白質組學的篩選和腦片電生理、光纖鈣信號和組織化學等方法的驗證,證明海馬神經(jīng)元突觸可塑性的增強、神經(jīng)元活性的增加以及小膠質細胞對淀粉樣斑塊的內吞作用可能是改善記憶的關鍵機制(圖2)。
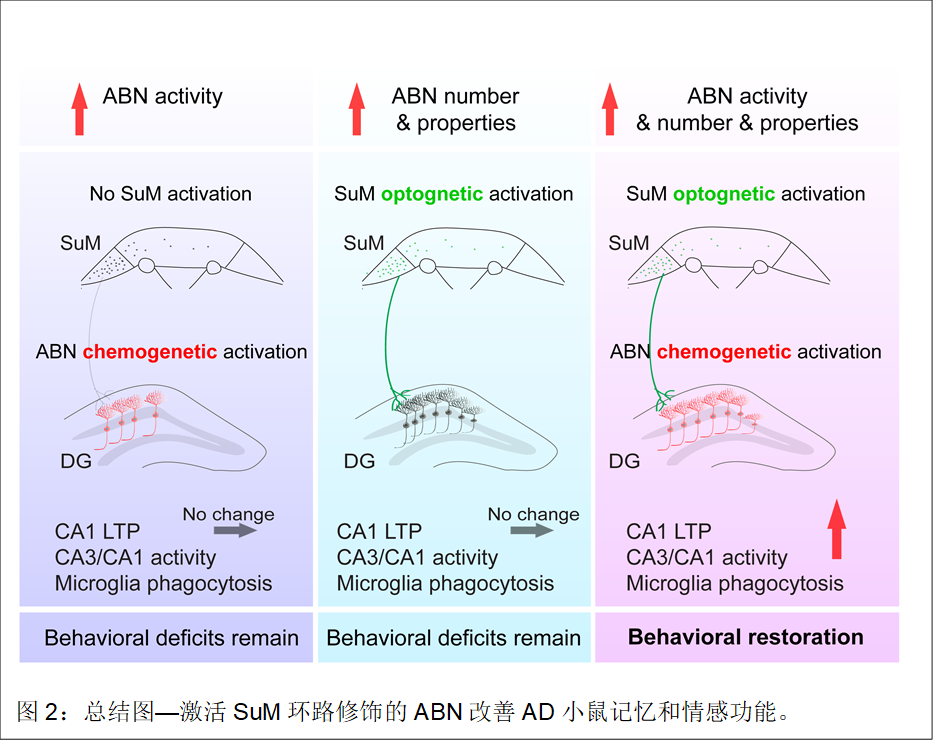
本研究是在前期發(fā)現(xiàn)刺激下丘腦覺醒核團SuM促進空間記憶提取基礎上,進一步探索覺醒環(huán)路通過調控海馬神經(jīng)發(fā)生改善記憶的作用和獨特機制,并應用于AD認知情感障礙的干預。該研究亮點在于,只需調控少量(約300個)海馬新生神經(jīng)元即可實現(xiàn)對AD小鼠記憶情感功能的拯救,并提出了可能的分子機制,為改善AD認知情感功能提出新思路。
UNC Ling Xie研究員、Xian Chen教授和Leon Coleman副教授為該研究做出重要貢獻。
專家點評:
段樹民院士(中國科學院院士,浙江大學教授、醫(yī)藥學部主任,復旦大學腦科學轉化研究院院長,上海交通大學松江研究院院長)
記憶的發(fā)生和調控機制以及如何改善神經(jīng)退行性疾病(如AD)的記憶障礙是當今神經(jīng)科學研究的熱點和難點問題。宋娟課題組的最新研究從全新的角度提出調控經(jīng)過下丘腦SuM神經(jīng)環(huán)路修飾的海馬新生神經(jīng)元可能是改善AD小鼠記憶和情感障礙的新策略,并在機制上做出探索:發(fā)現(xiàn)激活SuM修飾的海馬新生神經(jīng)元增強海馬突觸可塑性,增加小膠質細胞對淀粉樣斑塊的吞噬作用,擴展了調控海馬神經(jīng)發(fā)生改善記憶的機制。
有趣的是,下丘腦SuM核團是重要的促覺醒腦區(qū)。我們前期研究發(fā)現(xiàn)激活基底前腦膽堿能神經(jīng)元促覺醒(韓勇,Current biology 2014),而基底前腦膽堿能神經(jīng)元對海馬依賴的記憶編碼發(fā)揮重要調控作用,且在AD中受損。以上研究提示覺醒系統(tǒng)受損在AD記憶障礙發(fā)生中可能發(fā)揮重要作用。
黃志力教授(復旦大學基礎醫(yī)學院教授、藥理學系主任,中國睡眠研究會理事長)
覺醒是記憶和情感等行為的生物學基礎,覺醒異常會導致記憶和情感障礙。UNC宋娟課題組專注于下丘腦覺醒核團乳頭上核(SuM)控記憶的作用和機制研究,在前期發(fā)現(xiàn)SuM促進記憶提取(eLife 2020)的基礎上,提出SuM通過調控海馬神經(jīng)發(fā)生促進學習記憶的作用和新機制(Nat Neurosci 2022;Curr Opin Neurobiol2023),并將該策略應用于AD認知情感障礙的干預(Cell Stem Cell, 2023)。
AD的覺醒睡眠障礙的發(fā)生早于記憶損害,該研究的發(fā)現(xiàn)提示干預覺醒系統(tǒng)可能是改善AD記憶障礙的新策略。
李亞東博士簡介:
上海交通大學松江研究院研究員、獨立PI,博士生導師
李亞東課題組在生理和病理(神經(jīng)退行性疾病)狀態(tài)下,研究覺醒調控記憶的作用和機制,使用EEG/EMG記錄、在體/離體電生理、高分辨率單/雙光子成像、在體多通道鈣信號記錄、蛋白質組學和光/化學遺傳學操控方法等技術,發(fā)現(xiàn)了腹側基底神經(jīng)節(jié)環(huán)路中伏隔核和腹側蒼白球2個重要的覺醒核團,為進一步研究覺醒調控記憶的神經(jīng)環(huán)路夯實了基礎(Molecular Psychiatry,2021;Nature Communications,2018);揭示了下丘腦覺醒環(huán)路促進成年海馬神經(jīng)發(fā)生、改善記憶的獨特機制,提出了通過提高覺醒水平,促進海馬神經(jīng)發(fā)生改善學習記憶的新思路(eLife,2020;Nature Neuroscience,2022,Current Opinion in Neurobiology, 2023),并初步應用于改善AD認知和情感障礙(Cell Stem Cell,2023,J Transl Med, 2023)。
代表性論著(#共同第一作者,*通訊作者):
1. Li Y#, Luo Y#, Xie L, Tart D, Sheehy R, Zhang L, Coleman L, Chen X, Song J* (2023). Activation of hypothalamic-enhanced adult-born neurons restores cognitive and affective function in Alzheimer's disease,Cell Stem Cell, 31:1–18.
2. Li Y#, Luo Y#, Chen Z, Quintanilla L, Cherasse Y, Lazarus M, Huang Z, Song J* (2022). Hypothalamic modulation of adult hippocampal neurogenesis in mice confers activity-dependent regulation of memory and anxiety-like behavior.Nat Neurosci,25:630-45.
3. Li Y#; Luo Y#, Xu W, Ge J, Cherasse Y, Wang Y, Lazarus M, Qu W* & Huang Z* (2021). Ventral pallidal GABAergic neurons control wakefulness associated with motivation through the ventral tegmental pathway.Mol Psychiatry,26:2912-28.
4. Li Y, Bao H, Luo Y, Sullivan Y, Quintanilla L, Wickersham I, Lazarus M, Shin Y, Song J* (2020). Supramammillary nucleus synchronizes with dentate gyrus to regulate spatial memory retrieval through glutamate release.eLife,9:e53129.
5. Wander C#,Li Y#,*, Bao H, Asrican B, Luo Y, Sullivan H, Chao T, W, Samantha L, Tart D, Chen Z, Shih Y, Wickersham I, Cohen T, Song J*. Compensatory remodeling of a septo-hippocampal GABAergic network in the triple transgenic Alzheimer’s mouse model, J Transl Med, 2023, in press
6. Li Y#, Luo Y#, Song J* (2023); Optimizing memory performance and emotional states: multi-level enhancement of adult hippocampal neurogenesis,Curr Opin Neurobiol, 79.
7. Li Y#, Ge J#, Luo Y#, Xu W, Wang J, Lazarus M, Hong Z, Qu W*, Huang Z* (2019). High cortical delta power correlates with aggravated allodynia by activating anterior cingulate cortex GABAergic neurons in neuropathic pain mice,PAIN, 161:288-299
8. Luo Y#,Li Y#, Wang L#, Yang S, Yuan X, Wang J, Cherasse Y, Lazarus M, Chen J, Qu W*, Huang Z* (2018). Nucleus accumbens controls wakefulness by a subpopulation of neurons expressing dopamine D1 receptors.Nat Commun,9(1):1576.
9. Wu Y#,Li Y#, Luo Y, Wang T, Wang H*, Chen S, Qu W, Huang Z*(2015). Gelsemine alleviates both neuropathic pain and sleep disturbance in partial sciatic nerve ligation mice,Acta Pharmacol Sin, 11(36): 1308-1317
10. Asrican B#, Wooten J#,Li Y, Quintanilla L, Zhang F, Wander C, Bao H, Yeh C, Luo Y, Olsen R, Lim S, Hu J, Jin P, Song J* (2020). Neuropeptides modulate local astrocytes to regulate adult hippocampal neural stem cells,Neuron, 108(2): 349-366[LY1]
