缺氧是惡性實體腫瘤的典型特征之一。缺氧與腫瘤的血管生成、轉(zhuǎn)移和耐藥性密切相關。上海交通大學醫(yī)學院附屬第九人民醫(yī)院骨科郝永強教授研究團隊針對惡性實體腫瘤易復發(fā)、對放化療不敏感等制約臨床療效的關鍵“瓶頸”問題,自主研發(fā)了一種高釋氧的納米復合材料體系,為改善腫瘤的缺氧微環(huán)境并提高耐藥性實體瘤的化療療效提供了一種嶄新途徑。
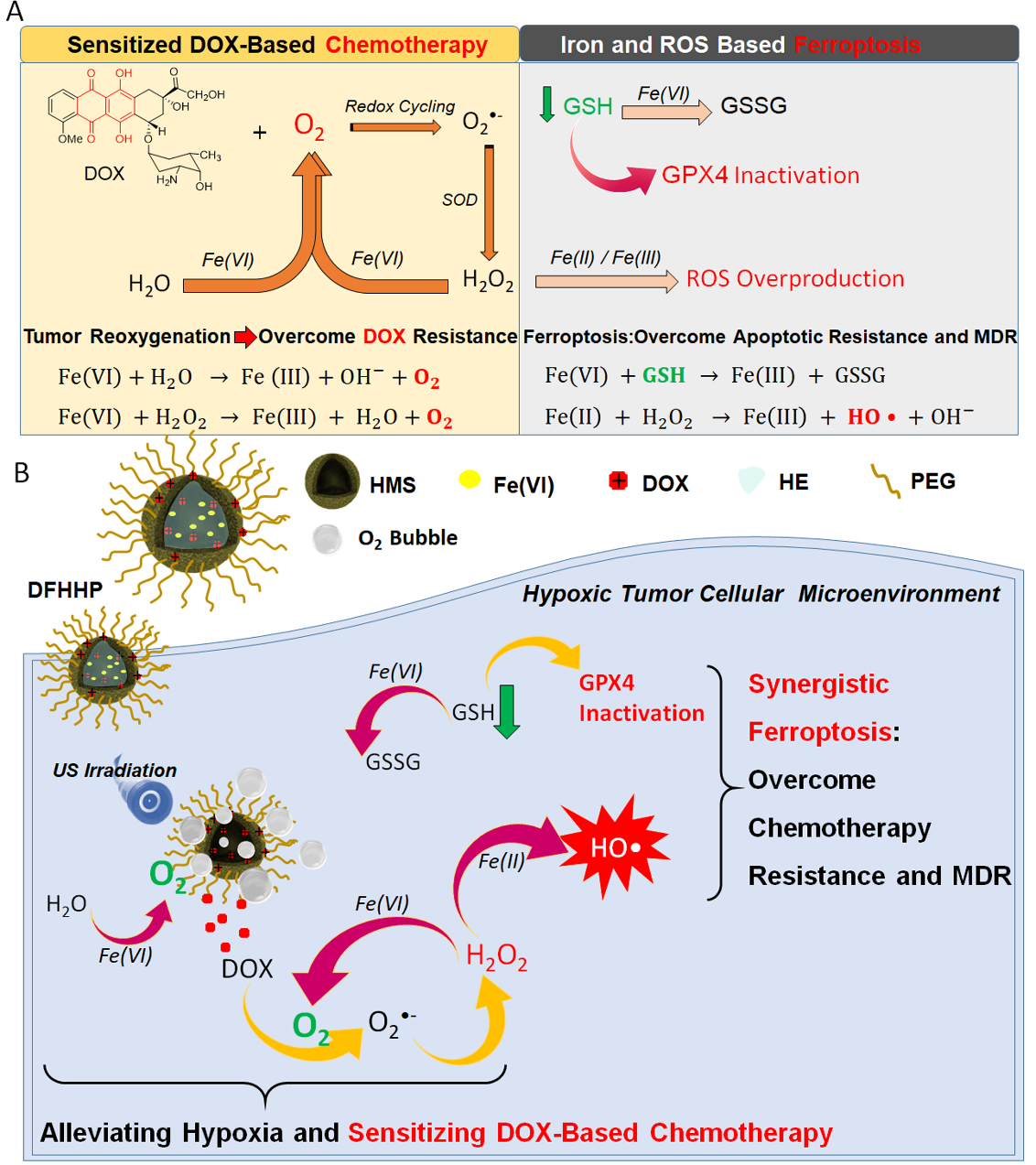
化療主要誘導Caspase依賴性細胞凋亡。然而,由于腫瘤內(nèi)凋亡抑制劑和腫瘤多藥耐藥的過度表達導致腫瘤細胞對化療的敏感性降低。鐵死亡是一種完全不同于凋亡、壞死、自噬和其他形式細胞死亡的程序性細胞死亡形式,主要表現(xiàn)為鐵依賴性脂質(zhì)過氧化物的堆積及質(zhì)膜多不飽和脂肪酸的耗竭。通過鐵死亡與凋亡協(xié)同作用,有望克服腫瘤的凋亡抵抗和多藥耐藥,為化療耐藥性腫瘤治療提供一種新的治療策略。基于此,郝永強教授研究團隊開發(fā)了一種超聲波響應性激活的Fe(VI)基納米釋氧體系,通過緩解腫瘤缺氧微環(huán)境,提高腫瘤細胞對化療藥物阿霉素(DOX)的敏感性。具體而言,腫瘤細胞內(nèi)氧含量的增加將促進氧參與的氧化還原循環(huán),激活DOX生成大量高活性的超氧陰離子自由基(O2?-)。細胞內(nèi)的超氧化物歧化酶(SOD)可進一步催化O2?-生成過氧化氫(H2O2)。這些H2O2,連同腫瘤細胞中過度表達的H2O2,可進一步作為Fe介導的氧化還原反應的底物,進一步增強腫瘤組織內(nèi)的氧含量。更為重要的是,F(xiàn)e(VI)基納米復合材料體系可以通過細胞內(nèi)的Fenton反應將腫瘤細胞高表達的H2O2轉(zhuǎn)化為高活性的羥基自由基,誘導鐵死亡。此外,谷胱甘肽過氧化物酶4(GPX4)是鐵死亡的另一個重要調(diào)控靶點。GPX4的失活抑制自由基和脂質(zhì)過氧化物的減少,導致自由基的過度產(chǎn)生,從而導致不可逆的細胞死亡。Fe(VI)基納米復合材料體系可以將腫瘤細胞中過度表達的還原型谷胱甘肽(GSH)轉(zhuǎn)化為氧化型谷胱甘肽(GSSG)。由于GSH是一種重要的細胞內(nèi)抗氧化劑,作為GPX4的共底物保護細胞免受氧化損傷,因此,GSH的耗竭會使GPX4的活性失活,誘發(fā)鐵死亡。值得注意的是,超聲波輻照具有腫瘤靶向性,能夠?qū)δ[瘤微環(huán)境進行特異性調(diào)節(jié),并以最小的副作用獲得更顯著的協(xié)同抗癌效果,這對于進一步的臨床轉(zhuǎn)化非常重要。
團隊于2020年11月17日在著名學術期刊《生物材料》(《Biomaterials》)在線發(fā)表了該研究成果,題目為“可激活的納米藥物體系通過誘導凋亡和鐵死亡協(xié)同作用克服缺氧誘導的化療耐藥性并有效抑制腫瘤生長”(“Activatable nanomedicine for overcoming hypoxia-induced resistance to chemotherapy and inhibiting tumor growth by inducing collaborative apoptosis and ferroptosis in solid tumors”)。論文的第一作者為骨科助理研究員符靜珂。