上海交通大學(xué)醫(yī)學(xué)院-國(guó)家熱帶病研究中心全球健康學(xué)院郭曉奎教授團(tuán)隊(duì),依托國(guó)家重點(diǎn)研發(fā)計(jì)劃“中國(guó)和英國(guó)政府間流行病預(yù)防與抗微生物耐藥性“大健康”旗艦挑戰(zhàn)計(jì)劃項(xiàng)目——基于全健康的中英細(xì)菌耐藥動(dòng)態(tài)變化規(guī)律及驅(qū)動(dòng)因素研究”,在崇明島針對(duì)鸻鷸類候鳥開展了微生物耐藥性(AMR)監(jiān)測(cè)工作。近日,該團(tuán)隊(duì)的研究成果在國(guó)際生態(tài)學(xué)權(quán)威期刊 Environment International 上在線發(fā)表,首次從分子流行病學(xué)角度揭示了東亞-澳大利西亞遷徙候鳥中三代頭孢菌素耐藥性腸桿菌(3GCRE)的傳播特性及其關(guān)鍵耐藥質(zhì)粒溯源。

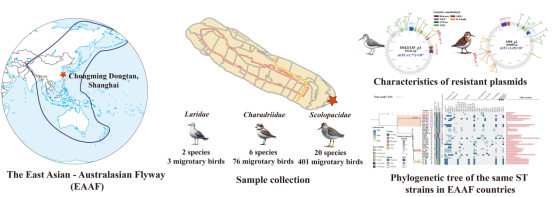
在全球抗菌藥物耐藥性問題日益嚴(yán)峻的背景下,候鳥由于其長(zhǎng)距離遷徙特性,不僅成為生態(tài)系統(tǒng)中耐藥菌傳播的“受害者”,同時(shí)也充當(dāng)著耐藥基因的“擴(kuò)散器”。本研究以東亞-澳大利亞遷徙路線(EAAF)為切入點(diǎn),通過對(duì)候鳥體內(nèi)耐藥菌的監(jiān)測(cè)與基因組追蹤,旨在揭示耐藥質(zhì)粒的跨物種、跨區(qū)域傳播機(jī)制,為全球AMR防控與生態(tài)安全提供科學(xué)依據(jù)。
上海交通大學(xué)醫(yī)學(xué)院-國(guó)家熱帶病研究中心全球健康學(xué)院基于交大崇明校區(qū)的建設(shè),依托崇明島豐富的濕地生態(tài)資源,與英國(guó)愛丁堡大學(xué)攜手,在“全健康”(One Health)理念指導(dǎo)下,針對(duì)候鳥-人類-環(huán)境交匯的復(fù)雜網(wǎng)絡(luò),開展了耐藥菌動(dòng)態(tài)變化規(guī)律及驅(qū)動(dòng)因素的對(duì)比研究。本項(xiàng)目為中英在細(xì)菌耐藥性研究領(lǐng)域搭建了國(guó)際合作新平臺(tái),旨在通過跨學(xué)科、跨國(guó)界的合作,共同構(gòu)建生態(tài)、動(dòng)物與人群聯(lián)防聯(lián)控的耐藥防控體系。
本研究在2023年春秋兩季候鳥遷徙期間,于上海崇明東灘國(guó)家級(jí)自然保護(hù)區(qū)內(nèi),對(duì)28個(gè)鸻鷸類候鳥種類共480只進(jìn)行了現(xiàn)場(chǎng)采樣,總計(jì)獲得893份咽拭子和泄殖腔拭子樣本,并從中分離出6株耐三代頭孢菌素的腸桿菌,其中包括:4株腸外致病性大腸埃希菌(其中1株來(lái)自大濱鷸、1株來(lái)自翹嘴鷸、2株來(lái)自環(huán)頸鸻)和2株肺炎克雷伯菌(分別來(lái)源于長(zhǎng)趾濱鷸與尖尾濱鷸)。
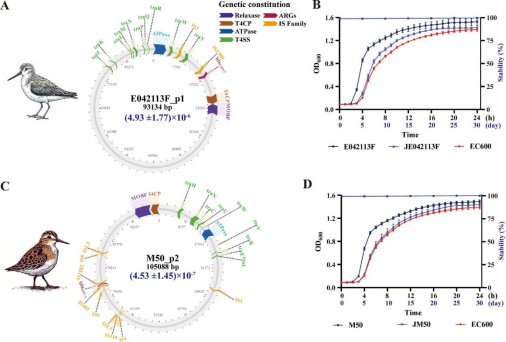
研究團(tuán)隊(duì)采用二代和三代高通量測(cè)序平臺(tái),對(duì)從候鳥體內(nèi)分離出的耐藥菌株進(jìn)行全基因組測(cè)序,重點(diǎn)解析耐藥質(zhì)粒的結(jié)構(gòu)及其攜帶的耐藥基因。聚焦于兩種關(guān)鍵的接合性耐藥質(zhì)粒:1. E042113F_p1質(zhì)粒:源自大腸埃希菌,攜帶關(guān)鍵耐藥基因 blaCMY-2; 2. M50_p2質(zhì)粒:源自耐碳青霉烯肺炎克雷伯菌,攜帶關(guān)鍵耐藥基因 blaKPC-2。實(shí)驗(yàn)結(jié)果顯示,這兩種質(zhì)粒在轉(zhuǎn)移至不同宿主菌過程中幾乎不產(chǎn)生適應(yīng)性代價(jià),并能穩(wěn)定傳代超過30次,表明其在環(huán)境中的擴(kuò)散能力極強(qiáng)。
研究人員結(jié)合NCBI公開數(shù)據(jù)庫(kù)中來(lái)自EAAF遷徙路線各國(guó)鳥類分離到的大腸埃希菌與肺炎克雷伯菌數(shù)據(jù),構(gòu)建了一個(gè)全面的基因組數(shù)據(jù)庫(kù),對(duì)耐藥質(zhì)粒的分布與演化進(jìn)行了跨國(guó)比對(duì)。通過基因組信息追蹤及系統(tǒng)進(jìn)化樹構(gòu)建,研究發(fā)現(xiàn),與E042113F_p1質(zhì)粒相似的耐藥載體最早于2015年在中國(guó)燕子體內(nèi)被檢測(cè)到,隨后在2017年蒙古、2018年俄羅斯和2019年澳大利亞的野生候鳥中陸續(xù)出現(xiàn)。分析結(jié)果顯示,這兩種質(zhì)粒最早均可能來(lái)源于人類,提示耐藥質(zhì)粒很可能由人類逐步傳播到動(dòng)物體內(nèi),并通過候鳥遷徙途徑實(shí)現(xiàn)跨區(qū)域、跨國(guó)界的擴(kuò)散。進(jìn)一步的分子結(jié)構(gòu)解析表明,ISEcp1在blaCMY-2基因附近的存在,以及tnpr-ISKpn27-blaKPC-2-ISKpn6的復(fù)合結(jié)構(gòu),在重塑質(zhì)粒結(jié)構(gòu)及促進(jìn)耐藥基因在質(zhì)粒間傳播中發(fā)揮了關(guān)鍵作用,這為理解耐藥性在細(xì)菌間的迅速擴(kuò)散提供了重要分子機(jī)制依據(jù)。
本研究表明,長(zhǎng)途遷徙的鳥類活動(dòng)對(duì) AMR 的傳播和擴(kuò)散構(gòu)成了重大風(fēng)險(xiǎn),警示生態(tài)系統(tǒng)、動(dòng)物健康及公共衛(wèi)生安全均可能受到嚴(yán)重影響。基因組追蹤與系統(tǒng)進(jìn)化分析顯示,兩種關(guān)鍵耐藥質(zhì)粒最早可能來(lái)源于人類,表明人類抗菌藥物濫用與環(huán)境污染可能為耐藥基因跨物種傳播提供“啟動(dòng)器”。因此,加強(qiáng)抗菌藥物管理、改善環(huán)境衛(wèi)生條件及構(gòu)建基于“全健康”理念的防控體系已迫在眉睫。
上海交通大學(xué)醫(yī)學(xué)院-國(guó)家熱帶病研究中心全球健康學(xué)院博士研究生程子樂、碩士研究生陳祎雯和實(shí)驗(yàn)師李敏為本文的共同第一作者,全球健康學(xué)院朱泳璋副教授、郭曉奎教授和中國(guó)醫(yī)學(xué)科學(xué)院醫(yī)學(xué)生物學(xué)研究所姚宇峰教授為本文的共同通訊作者。本研究得到國(guó)家重點(diǎn)研發(fā)計(jì)劃(No.2024YFE0199000)、國(guó)家自然科學(xué)基金項(xiàng)目(No.32170141)、云南省“興滇英才支持計(jì)劃”(XDYC-CYCX-2023-0074)和美國(guó)中華醫(yī)學(xué)基金會(huì)(No.20-365)等基金的支持。
全文鏈接:https://doi.org/10.1016/j.envint.2025.109320