
孤獨(dú)癥譜系障礙(Autism Spectrum Disorder),又稱自閉癥,是一類嚴(yán)重影響兒童身心健康的神經(jīng)發(fā)育疾病,患者表現(xiàn)出嚴(yán)重程度不同的社交障礙以及重復(fù)刻板行為。根據(jù)美國疾控中心統(tǒng)計(jì),孤獨(dú)癥的發(fā)病率呈現(xiàn)逐年升高的趨勢(shì),最新的2022年美國孤獨(dú)癥患病率約為1/361。中國對(duì)于6~12歲孤獨(dú)癥兒童患病率的統(tǒng)計(jì)顯示,男孩約為0.44%~0.95%,女孩約為0.12%~0.30%2。遺傳因素是孤獨(dú)癥致病的最主要因素,近年來研究者們發(fā)現(xiàn)了大量的孤獨(dú)癥風(fēng)險(xiǎn)基因及致病基因突變3,4,目前研究多集中在基因突變導(dǎo)致孤獨(dú)癥的分子與環(huán)路機(jī)制上,是否可以運(yùn)用基因編輯方法對(duì)導(dǎo)致孤獨(dú)癥的基因突變在大腦內(nèi)進(jìn)行準(zhǔn)確的修復(fù)還未見報(bào)道。
2023年11月27日,上海交通大學(xué)醫(yī)學(xué)院松江研究院/中國科學(xué)院腦科學(xué)與智能技術(shù)卓越創(chuàng)新中心(神經(jīng)科學(xué)研究所)仇子龍團(tuán)隊(duì)與復(fù)旦大學(xué)腦科學(xué)轉(zhuǎn)化研究院程田林團(tuán)隊(duì)合作在國際神經(jīng)科學(xué)權(quán)威期刊Nature Neuroscience雜志上發(fā)表題為Whole-brain in vivo base editing reverses behavioral changes in Mef2c mutant mice的研究論文,首次報(bào)道了在全腦范圍內(nèi)利用單堿基編輯技術(shù)成功改善Mef2c孤獨(dú)癥小鼠模型神經(jīng)發(fā)育與孤獨(dú)癥樣核心行為表型。
仇子龍研究團(tuán)隊(duì)通過全外顯子組測(cè)序技術(shù)在一例中國的孤獨(dú)癥患兒的MEF2C基因上發(fā)現(xiàn)了一個(gè)新發(fā)點(diǎn)突變(de novo mutation), c.T104C, p.L35P, MEF2C基因已被證實(shí)是一個(gè)很重要的孤獨(dú)癥風(fēng)險(xiǎn)基因,突變會(huì)導(dǎo)致神經(jīng)發(fā)育遲滯及一系列嚴(yán)重癥狀5,但是該新發(fā)點(diǎn)突變對(duì)于MEF2C基因功能的影響未知。研究團(tuán)隊(duì)首先利用分子細(xì)胞生物學(xué)的研究方法在體外探究了 L35P 點(diǎn)突變對(duì) MEF2C 蛋白結(jié)構(gòu)、表達(dá)以及功能上的影響及其分子機(jī)制 (圖I和圖II)。 研究團(tuán)隊(duì)發(fā)現(xiàn) L35P 突變會(huì)導(dǎo)致 MEF2C 蛋白質(zhì)發(fā)生依賴泛素化蛋白酶體途徑的快速降解(圖II),最終顯著降低MEF2C蛋白的表達(dá)水平(圖I)。
為了研究 L35P 基因突變對(duì)小鼠行為學(xué)表型的影響,研究團(tuán)隊(duì)構(gòu)建了Mef2c L35P 點(diǎn)突變敲入小鼠模型,并通過生物化學(xué)、免疫熒光成像以及行為學(xué)實(shí)驗(yàn)探究了其神經(jīng)發(fā)育及行為學(xué)表型。研究發(fā)現(xiàn)Mef2c L35P 雜合突變小鼠大腦中存在孤獨(dú)癥相關(guān)的神經(jīng)生理學(xué)特征以及發(fā)育異常現(xiàn)象,并且表現(xiàn)出社交障礙以及刻板行為等孤獨(dú)癥核心癥狀的行為學(xué)表型(圖III)。
隨后,為了修復(fù)小鼠大腦神經(jīng)元中的L35P點(diǎn)突變,仇子龍和程田林團(tuán)隊(duì)合作開發(fā)了一種基于CRISPR/Cas9 的新型胞嘧啶單堿基編輯系統(tǒng)(APOBEC3A embedding Cytosine Base Editor,AeCBE,已申請(qǐng)相關(guān)發(fā)明專利),使其能夠?qū)?/span>小鼠Mef2c基因中特定位置上異常的C·G堿基對(duì)轉(zhuǎn)換成正常的T·A堿基對(duì)。為了能夠使得新型CBE系統(tǒng)成功地跨越小鼠血腦屏障(blood brain barrier, BBB),研究團(tuán)隊(duì)將AeCBE系統(tǒng)包裝進(jìn)PHP.eB血清型的腺相關(guān)病毒(Adeno-associated virus,AAV)中,并且利用單次小鼠尾靜脈注射AAV的遞送方式,使得AeCBE系統(tǒng)在小鼠大腦中多個(gè)腦區(qū)得以成功表達(dá)。經(jīng)AeCBE系統(tǒng)編輯后,研究團(tuán)隊(duì)在體內(nèi)檢測(cè)到較高的單堿基編輯效率以及低脫靶事件,驗(yàn)證了新開發(fā)的AeCBE系統(tǒng)具備高效性、準(zhǔn)確性且安全性的特點(diǎn)(圖IV)。
最后,研究團(tuán)隊(duì)檢測(cè)了經(jīng)過AeCBE系統(tǒng)介導(dǎo)的基因治療后Mef2c L35P突變雜合小鼠大腦中的神經(jīng)生理學(xué)變化以及行為學(xué)表型。在經(jīng)過單堿基編輯技術(shù)介導(dǎo)的基因修復(fù)后,研究團(tuán)隊(duì)發(fā)現(xiàn)Mef2c L35P突變雜合小鼠大腦中降低的Mef2c蛋白表達(dá)水平得到恢復(fù),并且其社交障礙以及重復(fù)刻板性行為也得到了明顯的改善。
本工作提出了利用具有自主知識(shí)產(chǎn)權(quán)的單堿基編輯系統(tǒng)在全腦水平修復(fù)單核苷酸致病突變的體內(nèi)基因編輯策略,為設(shè)計(jì)神經(jīng)遺傳疾病的基因編輯干預(yù)治療方案提供了全新思路。
上海交通大學(xué)醫(yī)學(xué)院松江研究院/中國科學(xué)院腦智卓越中心仇子龍研究員和復(fù)旦大學(xué)腦科學(xué)轉(zhuǎn)化研究院程田林研究員為該論文共同通訊作者。中國科學(xué)院腦智卓越中心李維克博士,復(fù)旦大學(xué)腦科學(xué)轉(zhuǎn)化研究院博士生張淑倩為該論文共同第一作者。中國科學(xué)院腦智卓越中心彭婉玲、石玉含、袁博、袁依婷、王錦程、韓文建、陳枝芳、單仕芳、上海交通大學(xué)醫(yī)學(xué)院附屬第九人民醫(yī)院薛震宇、復(fù)旦大學(xué)腦科學(xué)轉(zhuǎn)化研究院陳金龍、張成以及復(fù)旦大學(xué)腦科學(xué)研究院薛碧清對(duì)該工作做出重要貢獻(xiàn)。該研究工作得到了中國科學(xué)院腦智卓越中心許曉鴻研究員、竺淑佳研究員、臨港實(shí)驗(yàn)室徐華泰研究員和復(fù)旦大學(xué)腦科學(xué)研究院邰一琳研究員的重要指導(dǎo)。該研究工作還得到了中國科學(xué)院腦智卓越中心分子細(xì)胞平臺(tái),實(shí)驗(yàn)動(dòng)物平臺(tái)與光學(xué)成像平臺(tái)大力支持。
上海交通大學(xué)醫(yī)學(xué)院松江研究院仇子龍研究員實(shí)驗(yàn)室(http://dripwizz.com/sri/kxyj/yjdw1/js/czl.htm)長期致力于孤獨(dú)癥的神經(jīng)生物學(xué)研究工作,從孤獨(dú)癥的遺傳學(xué)分析、神經(jīng)發(fā)育機(jī)制、分子神經(jīng)生物學(xué)與基因編輯干預(yù)等方面開展工作,長期招收相關(guān)專業(yè)博士后,請(qǐng)有志學(xué)子與仇子龍研究員直接聯(lián)系([email protected])。
復(fù)旦大學(xué)腦科學(xué)轉(zhuǎn)化研究院程田林研究員實(shí)驗(yàn)室(https://itbr.fudan.edu.cn/info/1202/1805.htm)致力于基因編輯技術(shù)研發(fā)及各類遺傳病基因治療研究,長期招收相關(guān)專業(yè)博士后,請(qǐng)有志學(xué)子與程田林研究員直接聯(lián)系([email protected])。
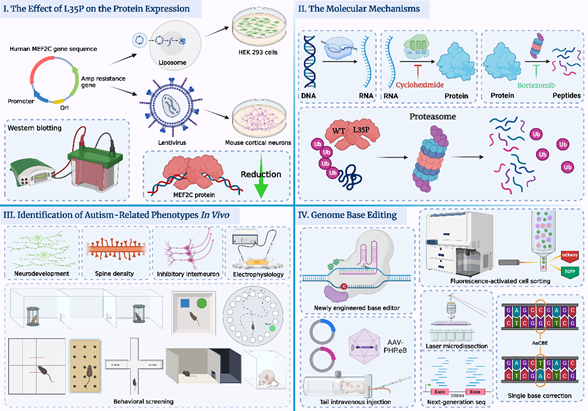
圖I: L35P點(diǎn)突變顯著降低MEF2C蛋白表達(dá)水平。
圖II:L35P點(diǎn)突變通過泛素化蛋白酶體降解途徑介導(dǎo)MEF2C蛋白翻譯后快速降解。
圖III:Mef2c L35P雜合小鼠表現(xiàn)出與孤獨(dú)癥相關(guān)的異常神經(jīng)發(fā)育,突觸密度降低,抑制性中間神經(jīng)元數(shù)量下降及異常的電生理表型,且出現(xiàn)孤獨(dú)癥相關(guān)的行為學(xué)表型。
圖IV: 基于CRISPR/Cas9系統(tǒng)開發(fā)的新型胞嘧啶單堿基編輯系統(tǒng),通過體內(nèi)及體外驗(yàn)證了其在目標(biāo)靶點(diǎn)的堿基編輯效率以及脫靶事件,證明該系統(tǒng)是高效,準(zhǔn)確且安全的。
原文鏈接:
https://www.nature.com/articles/s41593-023-01499-x
參考文獻(xiàn)
1.Maenner, M. J. et al. Prevalence and Characteristics of Autism Spectrum Disorder Among Children Aged 8 Years - Autism and Developmental Disabilities Monitoring Network, 11 Sites, United States, 2020. MMWR Surveill Summ 72, 1-14 (2023). https://doi.org:10.15585/mmwr.ss7202a1
2.Zhou, H. et al. Prevalence of Autism Spectrum Disorder in China: A Nationwide Multi-center Population-based Study Among Children Aged 6 to 12 Years. Neurosci Bull 36, 961-971 (2020). https://doi.org:10.1007/s12264-020-00530-6
3.Geschwind, D. H. & Flint, J. Genetics and genomics of psychiatric disease. Science 349, 1489-1494 (2015). https://doi.org:10.1126/science.aaa8954
4.Sanders, S. J. et al. De novo mutations revealed by whole-exome sequencing are strongly associated with autism. Nature 485, 237-241 (2012). https://doi.org:10.1038/nature10945
5.Parikshak, N. N. et al. Integrative functional genomic analyses implicate specific molecular pathways and circuits in autism. Cell 155, 1008-1021 (2013). https://doi.org:10.1016/j.cell.2013.10.031
同行專家評(píng)論:牛煦然博士,魏文勝教授(北京大學(xué))
孤獨(dú)癥譜系障礙(Autism spectrum disorder, ASD)(亦稱“自閉癥”)是一類神經(jīng)發(fā)育障礙性疾病,患者往往有社交、語言等方面的障礙,并會(huì)存在重復(fù)刻板的行為。隨著1988年著名電影Rain Man的上映,這一疾病更加為人所知。目前,ASD已被明確報(bào)道存在高度遺傳傾向。在包括中國和韓國在內(nèi)的東亞ASD人群隊(duì)列研究中,MEF2C這一基因的突變已經(jīng)被發(fā)現(xiàn)和ASD發(fā)病相關(guān)。MEF2C在小鼠神經(jīng)元分化、神經(jīng)發(fā)育和突觸可塑性中發(fā)揮著重要作用,暗示這一基因可能通過影響神經(jīng)系統(tǒng)發(fā)育而產(chǎn)生ASD疾病表型。
近日,上海交通大學(xué)醫(yī)學(xué)院松江研究院/中科院腦智卓越中心仇子龍課題組與復(fù)旦大學(xué)腦科學(xué)轉(zhuǎn)化研究院程田林課題組合作在Nature Neuroscience上發(fā)表了題為Whole-brain in vivo base editing reverses behavioral changes in Mef2c mutant mice的研究論文。該文章通過全外顯子組測(cè)序在患者中發(fā)現(xiàn)了MEF2C基因上的一個(gè)de novo SNV(c.104T > C, p.L35P),并證實(shí)了該突變會(huì)影響MEF2C的泛素化降解途徑進(jìn)而影響蛋白水平。MEF2C-L35P敲入的雜合小鼠會(huì)出現(xiàn)明顯的新事物識(shí)別障礙、多動(dòng)、重復(fù)行為等ASD表型。由于該突變恰好可以被胞嘧啶堿基編輯器CBE所糾正,因此研究人員使用優(yōu)化的APOBEC內(nèi)嵌型CBE(AeCBE)結(jié)合雙AAV遞送的方式對(duì)Mef2c L35P+/-小鼠進(jìn)行了in vivo基因編輯治療,成功糾正了小鼠所存在的類ASD疾病表型。
本論文可圈可點(diǎn)之處,第一是在小鼠上精確模擬了人群中存在的SNV并得到了相似的ASD表型,為進(jìn)一步的研究提供了良好的模型基礎(chǔ);第二是使用優(yōu)化的AeCBE進(jìn)行編輯,不僅比AncBE4等編輯器效率更高,還使用了PAM為NGN的SpG Cas9,拓寬了編輯器的使用范圍;第三是使用了可以突破血腦屏障的AAV-PHP.eB,高效地將編輯系統(tǒng)遞送至小鼠全腦;第四是概念上證明了堿基編輯器可以通過一次給藥的方式,對(duì)腦部遺傳疾病進(jìn)行精準(zhǔn)且有效的基因治療,為未來ASD及相關(guān)遺傳疾病治療提供了良好的思路與范式。近期,仇子龍課題組還和上海交通大學(xué)醫(yī)學(xué)院附屬新華醫(yī)院李斐團(tuán)隊(duì)報(bào)道了中國孤獨(dú)癥人群的大規(guī)模全外顯子遺傳學(xué)研究。研究中所鑒定的多個(gè)高置信度的ASD候選基因及對(duì)應(yīng)的相關(guān)突變都有使用相似策略進(jìn)行研究和治療的價(jià)值。在今年3月,David Liu課題組也在Science上發(fā)文,使用雙AAV9載體遞送ABE編輯系統(tǒng)對(duì)脊髓型肌萎縮癥(SMA)小鼠進(jìn)行了治療。該策略主要針對(duì)脊髓運(yùn)動(dòng)神經(jīng)元,同樣可以實(shí)現(xiàn)一次給藥,終身治愈的目的。
當(dāng)然在未來,對(duì)于腦部遺傳病的基因治療還可以有更多優(yōu)化選擇策略,比如針對(duì)需編輯的致病位點(diǎn)多樣性,可以選擇不同PAM的Cas9進(jìn)一步拓寬使用范圍;可以使用AAV-PHP.eB進(jìn)一步優(yōu)化得到的AAV.CAP-B10血清型進(jìn)行更為高效精準(zhǔn)的神經(jīng)元遞送,或針對(duì)具體需求使用AAV-MG1.2等更加親和小膠質(zhì)細(xì)胞的血清型進(jìn)行遞送。除CBE之外,ABE編輯系統(tǒng)以及近期報(bào)道的多個(gè)基于ABE系統(tǒng)TadA脫氨酶進(jìn)化得到的新型CBE、CGBE、ACBE等編輯工具均有望在遺傳疾病的治療中得到應(yīng)用。基于ABE系統(tǒng)的編輯器整體安全性(包括脫靶效應(yīng)在內(nèi))比CBE更好,且有的變體具有良好的A5、C5等位置的窄窗口編輯效果,對(duì)于以治療為目的精準(zhǔn)編輯更為有利。與此同時(shí),由于ABE的整體系統(tǒng)更小,可以包裝入單個(gè)AAV內(nèi),因此ABE系統(tǒng)和如直接進(jìn)化TadA所得到的TadCBEs工具也有極大的in vivo基因治療潛力。
或許在未來,我們身邊的Rain Man,可以在飛速發(fā)展的基因編輯工具的應(yīng)用浪潮中,擁有Healthy Brain,成為走出孤獨(dú)世界的Brave Man。
同行專家評(píng)論:李大力教授(華東師范大學(xué))
人類致病性遺傳突變中有近6成為點(diǎn)突變,雖然基于CRISPR的HDR技術(shù)提供了堿基突變修復(fù)的可操作性,但受外源模板、修復(fù)機(jī)制等影響,HDR的編輯效率仍非常有限。此外,HDR介導(dǎo)的基因編輯往往依賴于細(xì)胞分裂,其應(yīng)用潛力更加受限。近年來, CRISPR衍生技術(shù)-堿基編輯器(BE)已成為廣受歡迎的堿基高效替換工具,它主要由Cas蛋白與脫氨酶或DNA損傷修復(fù)酶構(gòu)成,如CBE, ABE, CGBE/GBE 以及最近開發(fā)的腺嘌呤顛換編輯器(AYBE, AXBE, ACBE)等。因無需依賴外源模板和DSB,理論上也不依賴于細(xì)胞分裂,堿基編輯技術(shù)已廣泛應(yīng)用于生命科學(xué)的眾多領(lǐng)域,特別是基于血紅蛋白病、早衰癥、視網(wǎng)膜病變、神經(jīng)肌肉病、心肌病、耳聾等疾病的基因治療。
遺傳變異是導(dǎo)致多種神經(jīng)系統(tǒng)疾病發(fā)生的關(guān)鍵因素,因此能精準(zhǔn)修復(fù)致病突變的基因編輯技術(shù)在其中的治療潛力也廣受關(guān)注。考慮到神經(jīng)元在出生后很快失去分裂能力的特點(diǎn),BE較HDR在神經(jīng)系統(tǒng)疾病治療中更具有應(yīng)用的潛力和可行性,但BE是否真能用于逆轉(zhuǎn)大腦的致病突變而治療神經(jīng)發(fā)育障礙疾病(如自閉癥),目前尚未有相關(guān)報(bào)道。
近期發(fā)表在Nature Neuroscience的工作中,仇子龍和程田林團(tuán)隊(duì)合作首次鑒定了一個(gè)誘發(fā)自閉癥的罕見致病點(diǎn)突變(c.104T>C, p.L35P),該位點(diǎn)位于MEF2C基因MADS結(jié)構(gòu)域上,對(duì)于維持MEF2C蛋白穩(wěn)定性以及神經(jīng)元發(fā)育非常重要。研究者還發(fā)現(xiàn),攜帶該致病點(diǎn)突變的小鼠中也出現(xiàn)了神經(jīng)發(fā)育異常和自閉癥樣的行為表型,表明成功獲得了自閉癥疾病模型。為實(shí)現(xiàn)該致病位點(diǎn)的有效糾正,作者結(jié)合Cas9廣譜突變體SpG、脫氨酶APOBEC3A的高安全性突變體以及內(nèi)部嵌入策略,開發(fā)出了新型CBE工具-AeCBE。通過與經(jīng)典的CBE進(jìn)行對(duì)比,作者發(fā)現(xiàn)AeCBE在含有致病突變的小鼠原代皮層神經(jīng)元中具有最優(yōu)的胞嘧啶轉(zhuǎn)換編輯效率,證實(shí)了堿基編輯器用于非分裂細(xì)胞神經(jīng)元致病突變修復(fù)的可行性。最后使用內(nèi)含肽介導(dǎo)的拆分策略以及穿過血腦屏障(BBB)的AAV-PHPeB系統(tǒng)進(jìn)行體內(nèi)遞送,發(fā)現(xiàn)AeCBE在全腦Mef2c產(chǎn)生了高效的C-to-T編輯(~20%)且具有較低的脫靶風(fēng)險(xiǎn)。該治療能有效恢復(fù)Mef2c蛋白的表達(dá)水平,并有效改善了自閉癥小鼠的突觸功能和社交能力,也顯著降低了重復(fù)刻板行為的出現(xiàn)。
總之,這項(xiàng)工作發(fā)現(xiàn)了導(dǎo)致自閉癥的MEF2C致病新突變,探索了新突變的致病機(jī)理,還創(chuàng)新性開發(fā)出高效且更少旁觀者突變的AeCBE系統(tǒng),最終通過在體全腦堿基編輯首次實(shí)現(xiàn)了自閉癥小鼠的有效治療。該研究為自閉癥治療提供了新的思路,并進(jìn)一步表明了堿基編輯技術(shù)治療遺傳性腦部疾病的巨大潛力。
同行專家評(píng)論:朱俊杰博士、陳佳研究員(上海科技大學(xué))
自閉癥譜系障礙(ASD)是一種具有高度遺傳性的神經(jīng)發(fā)育障礙,表現(xiàn)為社交缺陷,以及重復(fù)或受限的行為1,2。目前為止,美國食品藥品監(jiān)督管理局(FDA)已批準(zhǔn)使用一些非典型抗精神病藥物治療自閉癥患者,例如利培酮(Risperdal)和阿立哌唑(Abilify),但往往伴隨著一些副作用。
有研究結(jié)果表明,MEF2C基因在成年小鼠的大腦皮質(zhì)、海馬體和杏仁核中大量表達(dá)3,其能夠調(diào)節(jié)突觸可塑性和谷氨酸能突觸的數(shù)量,是ASD相關(guān)基因網(wǎng)絡(luò)的調(diào)節(jié)基因之一4。MEF2C的突變會(huì)導(dǎo)致兒童大腦發(fā)育缺陷,其特征為精神運(yùn)動(dòng)障礙,缺乏言語,異常運(yùn)動(dòng)模式等5,6。
基于CRISPR/Cas9的基因編輯系統(tǒng)已被廣泛應(yīng)用于研究和治療各種遺傳疾病,如遺傳性轉(zhuǎn)甲狀腺素淀粉樣變性(hATTR)7、遺傳性血管性水腫(HAE)、阿爾茲海默癥(AD)8和亨廷頓舞蹈癥(HD)9等。但堿基編輯仍沒有得到廣泛應(yīng)用,尤其在神經(jīng)發(fā)育障礙治療領(lǐng)域。
仇子龍/程田林團(tuán)隊(duì)在最新發(fā)表的論文 Whole-brain in vivo base editing reverses behavioral changes in Mef2c mutant mice,為遺傳性神經(jīng)發(fā)育障礙的治療提供了新的思路。研究團(tuán)隊(duì)首先在ASD患者中鑒定出MEF2C基因中一種新的SNV(c.104T>C, p.L35P),構(gòu)建了Mef2c L35P+/-自閉癥譜系障礙小鼠模型,并進(jìn)一步研究Mef2c L35P突變對(duì)小鼠的影響。為了糾正這一突變,研究團(tuán)隊(duì)在SpG蛋白內(nèi)部融合了人胞苷脫氨酶APOBEC3A-Y130F10和尿嘧啶糖苷酶抑制劑(UGI),從而構(gòu)建了一種新的CBE工具- AeCBE。其具有編輯效率高,旁觀者編輯(bystander)和脫靶編輯(off-target editing)低等優(yōu)點(diǎn)。隨后,作者們采用可穿過血腦屏障的雙AAV系統(tǒng)(AAV-PHP.eB)和內(nèi)含肽介導(dǎo)的拆分策略,將AeCBE系統(tǒng)遞送至Mef2c L35P+/-小鼠模型中。通過NGS、免疫染色、行為學(xué)分析,電生理等手段,驗(yàn)證了AeCBE能夠在小鼠模型中高效編輯靶向位點(diǎn),并糾正Mef2c L35P+/-小鼠的自閉癥行為。
目前,自閉癥的治療是醫(yī)學(xué)中的難點(diǎn)之一,尚沒有特效藥能夠治療自閉癥。而在本研究中,作者們?cè)谇捌趫?bào)道的hA3A-BE3-Y130F堿基編輯器的基礎(chǔ)上構(gòu)建了一種新的CBE系統(tǒng),能夠在ASD小鼠模型中糾正MEF2C(c.104T>C)點(diǎn)突變,并糾正其自閉癥行為。雖然ASD的成因極其復(fù)雜,但這項(xiàng)研究證明了體內(nèi)堿基編輯在神經(jīng)發(fā)育障礙治療中的潛力,同時(shí)也為其他類型的堿基編輯器在腦內(nèi)遞送以及編輯帶來了新的啟發(fā)。
1 Colvert, E. et al. Heritability of Autism Spectrum Disorder in a UK Population-Based Twin Sample. JAMA Psychiatry 72, 415-423 (2015). https://doi.org:10.1001/jamapsychiatry.2014.3028
2 Geschwind, D. H. & Flint, J. Genetics and genomics of psychiatric disease. Science 349, 1489-1494 (2015). https://doi.org:10.1126/science.aaa8954
3 Leifer, D. et al. MEF2C, a MADS/MEF2-family transcription factor expressed in a laminar distribution in cerebral cortex. Proc Natl Acad Sci U S A 90, 1546-1550 (1993). https://doi.org:10.1073/pnas.90.4.1546
4 Parikshak, N. N. et al. Integrative functional genomic analyses implicate specific molecular pathways and circuits in autism. Cell 155, 1008-1021 (2013). https://doi.org:10.1016/j.cell.2013.10.031
5 Cardoso, C. et al. Periventricular heterotopia, mental retardation, and epilepsy associated with 5q14.3-q15 deletion. Neurology 72, 784-792 (2009). https://doi.org:10.1212/01.wnl.0000336339.08878.2d
6 Wright, C. F. et al. Non-coding region variants upstream of MEF2C cause severe developmental disorder through three distinct loss-of-function mechanisms. Am J Hum Genet 108, 1083-1094 (2021). https://doi.org:10.1016/j.ajhg.2021.04.025
7 Gillmore, J. D. et al. CRISPR-Cas9 In Vivo Gene Editing for Transthyretin Amyloidosis. N Engl J Med 385, 493-502 (2021). https://doi.org:10.1056/NEJMoa2107454
8 Gy?rgy, B. et al. CRISPR/Cas9 Mediated Disruption of the Swedish APP Allele as a Therapeutic Approach for Early-Onset Alzheimer's Disease. Mol Ther Nucleic Acids 11, 429-440 (2018). https://doi.org:10.1016/j.omtn.2018.03.007
9 Yang, S. et al. CRISPR/Cas9-mediated gene editing ameliorates neurotoxicity in mouse model of Huntington's disease. J Clin Invest 127, 2719-2724 (2017). https://doi.org:10.1172/jci92087
10 Wang, X. et al. Efficient base editing in methylated regions with a human APOBEC3A-Cas9 fusion. Nature Biotechnology 36, 946-949 (2018). https://doi.org:10.1038/nbt.4198
