9月26日,上海精準醫(yī)學研究院、附屬九院骨科曹禹研究員團隊、中國藥科大學于燁課題組聯(lián)合在《科學》(Science)以“First Release”的形式提前在線發(fā)表了研究論文“Structural basis for inositol pyrophosphate gating of the phosphate channel XPR1(磷酸通道XPR1受肌醇焦磷酸門控的結(jié)構(gòu)基礎(chǔ))”,揭示了焦磷酸肌醇如何調(diào)節(jié)XPR1開放并進行磷酸外排的分子機制。

磷酸是生物體內(nèi)最具功能多樣性的陰離子基團,不僅是多種生物分子的重要組成部分,還參與多種生化反應(yīng),并以其特征性的多電荷可逆修飾能力,成為多種生物學信號的攜帶者。除作為核酸、磷脂以及能量分子的組成而存在之外,無機磷的主要存在形式包括構(gòu)成骨骼主要部分的羥基磷灰石、游離磷酸根或焦磷酸。游離磷酸根是最重要的磷酸存在形式之一,一方面其作為能量代謝、信使分子合成、蛋白磷酸化等生物通路的前體分子必須維持一定水平,另一方面,過高的磷酸根濃度不僅對正常的生化反應(yīng)造成了干擾,還因其易與鈣、鐵等多價態(tài)金屬離子形成沉淀的原因威脅著人體的健康。為維持細胞內(nèi)磷酸水平的穩(wěn)定,生命在進化過程中形成了多種細胞膜上的轉(zhuǎn)運蛋白來負責磷酸的攝取和排放。在高等生物特別是人類中,盡管已經(jīng)發(fā)現(xiàn)了多種負責磷酸內(nèi)向運輸?shù)霓D(zhuǎn)運體蛋白,包括SLC20A、SLC34以及線粒體上的SLC25家族,能夠發(fā)揮磷酸外向運輸?shù)哪さ鞍啄壳皟H僅發(fā)現(xiàn)一種,即XPR1。
XPR1又稱SLC53A1,已有的遺傳學和生化研究表明,該蛋白主要負責在細胞內(nèi)磷酸過載的情況下向外釋放磷酸,這一釋放過程受到焦磷酸肌醇的激活,該分子在細胞內(nèi)磷酸水平異常升高時后大量產(chǎn)生,被視作為磷酸穩(wěn)態(tài)失衡的信號分子。XPR1功能受損的情況下將導致細胞內(nèi)磷酸的積累,從而影響細胞功能(例如引發(fā)破骨細胞功能受損)并引起磷酸鹽的析出積累,最終導致多組織器官出現(xiàn)鈣化。腦鈣化癥是由于磷酸鈣在腦部積累引發(fā)的神經(jīng)性疾病,有證據(jù)表明XPR1突變造成的磷酸外排受損將引起星形膠質(zhì)細胞向血液釋放磷酸能力不足,從而導致腦脊液中磷酸異常積累,最終產(chǎn)生磷酸鈣沉淀而引發(fā)病變。
XPR1在細胞中維持磷穩(wěn)態(tài)平衡的作用使之成為磷酸代謝研究與鈣化疾病探索的目標。然而,其結(jié)構(gòu)信息的缺乏使得人們難以理解其行使功能的分子細節(jié),特別是其如何受到焦磷酸肌醇的激活而進行磷酸外排的調(diào)控機制。
該論文的結(jié)果顯示,XPR1是由負責磷酸運輸?shù)牧姿嵬ǖ啦糠趾拓撠熃沽姿峒〈甲R別的信號感受器部分構(gòu)成的生物大分子機器:十跨膜螺旋構(gòu)成的跨膜結(jié)構(gòu)域(TMD)包圍形成了一個可供磷酸分子穿越細胞膜的孔道,這一孔道受到色氨酸573的禁控,隨著色氨酸573的旋轉(zhuǎn)移位而開放或關(guān)閉;細胞內(nèi)的可溶區(qū)SPX結(jié)構(gòu)域則形成了焦磷酸肌醇感受器結(jié)構(gòu),用于結(jié)合焦磷酸肌醇并控制TMD的構(gòu)象變化。然而,出乎意料的是,該研究論文發(fā)現(xiàn)XPR1同時存在兩個焦磷酸肌醇結(jié)合位點:第一結(jié)合位點位于SPX感受器之間,這一位點可以結(jié)合焦磷酸肌醇或磷酸肌醇,并通過結(jié)合焦磷酸肌醇或磷酸肌醇發(fā)生SPX之間的二聚化,穩(wěn)定TMD的構(gòu)象使之易于開放;第二結(jié)合位點則位于SPX與TMD之間,這一位點的特點是空間較大,兩側(cè)相距較遠的正電荷基團使之難于捕獲較小的磷酸肌醇分子,只有因為焦磷酸化而尺度較大的焦磷酸肌醇才能適配這一“空曠”口袋并與之結(jié)合。這一對焦磷酸具有偏好性的第二位點的發(fā)現(xiàn),解決了此前科學家的疑惑,即與磷酸肌醇相比,XPR1為何對于焦磷酸肌醇更為敏感,更容易被激活。
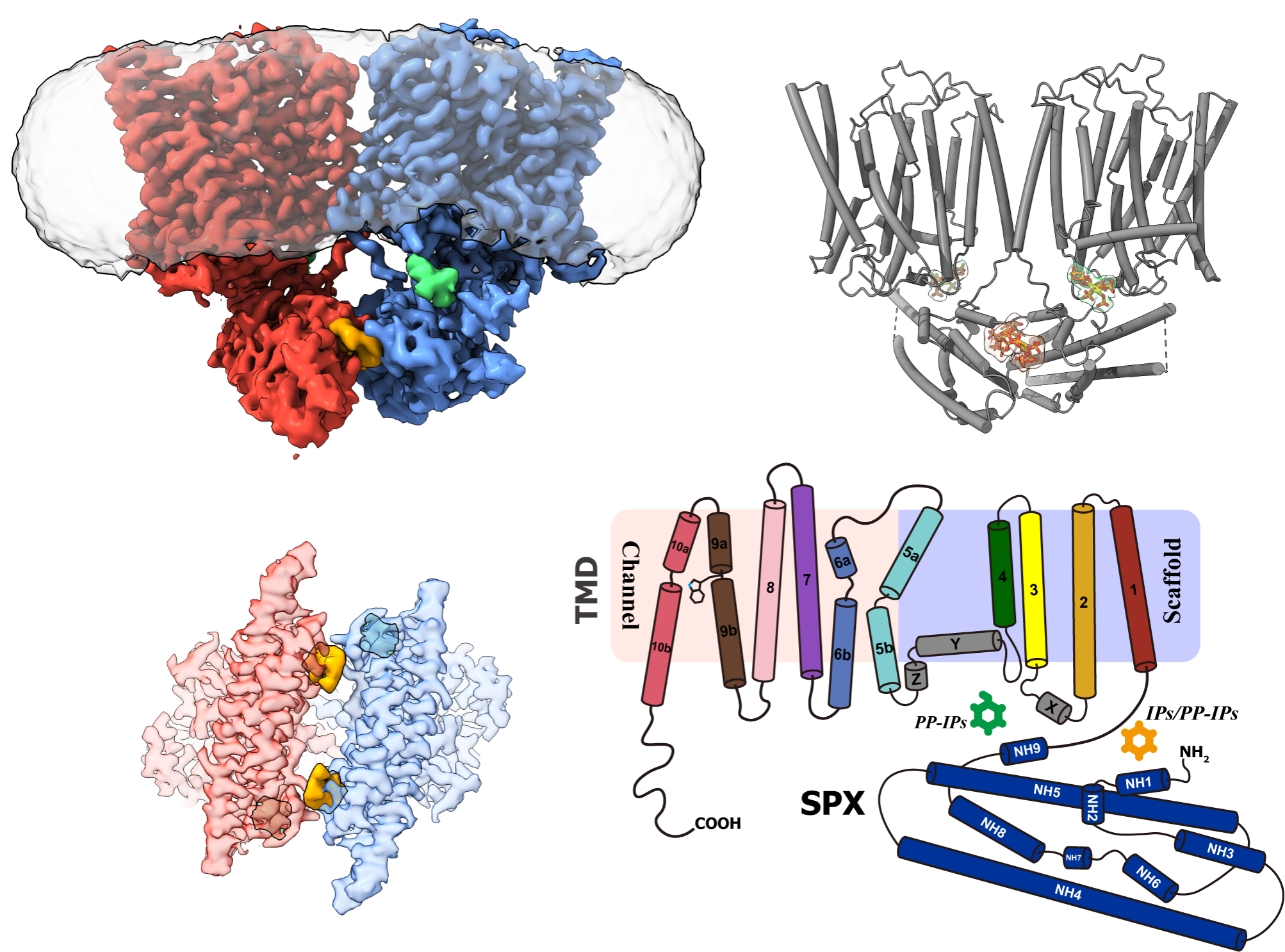
圖1:人類XPR1的冷凍電鏡密度圖和分子模型。
除解析了XPR1識別焦磷酸的結(jié)構(gòu)基礎(chǔ)之外,本研究還通過電生理的方法,首次表明XPR1實際上是作為磷酸通道發(fā)揮生物學作用,并非此前認定的轉(zhuǎn)運體蛋白。結(jié)合結(jié)構(gòu)生物學與功能生物學的研究結(jié)果,本論文提出XPR1是一個焦磷酸肌醇門控的磷酸通道,是細胞用于感知磷酸代謝信號并做出磷酸外排應(yīng)答的雙功能分子機器。這一研究為人們理解磷酸代謝與磷酸穩(wěn)態(tài)維持的細胞生物學機制提供了結(jié)構(gòu)基礎(chǔ),并為探索相關(guān)鈣化疾病的分子病理提供的指導與見解。
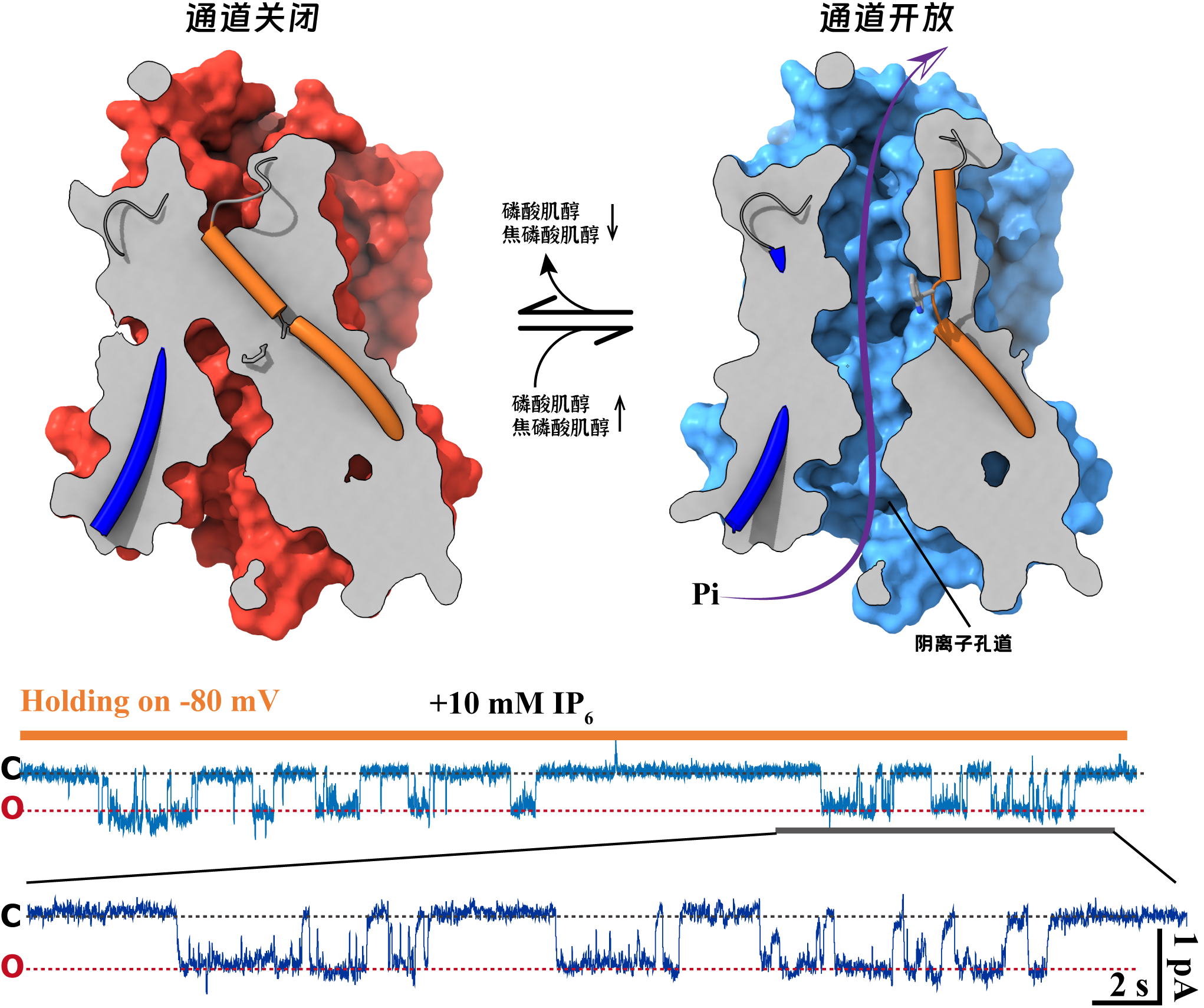
圖2:XPR1通道的開放與關(guān)閉
上海精準醫(yī)學研究院、附屬第九人民醫(yī)院骨科的曹禹研究員與中國藥科大學的于燁教授為該論文的共同通訊作者。附屬第九人民醫(yī)院的博士生魯毅、中國藥科大學的博士生岳晨茜、上海精準醫(yī)學研究院的畢業(yè)生張麗博士(現(xiàn)為美國西南醫(yī)學中心博士后研究員)以及附屬仁濟醫(yī)院的姚德強副研究員為該論文的共同第一作者。本研究中的冷凍電鏡數(shù)據(jù)的采集與加工分析均在本院電鏡中心進行。功能實驗主要在本院生物成像平臺、蛋白質(zhì)平臺與組學平臺完成。本論文研究的完成獲得了國家自然科學基金、上海市教委“IV類高峰”項目、上海高水平地方高校創(chuàng)新團隊與上海市運動系統(tǒng)退變與再生前沿科學基地的支持。