幽門螺桿菌(Helicobacter pylori, HP)是寄生于人類胃幽門部位的常見細(xì)菌病原體,其長(zhǎng)期感染易誘發(fā)慢性胃炎、胃潰瘍甚至胃癌,是全球感染人數(shù)最多且潛在致癌危害最大的致病菌之一。目前臨床上對(duì)HP的根除治療主要依賴多聯(lián)抗生素療法,然而多聯(lián)抗生素的長(zhǎng)期使用容易造成腸道菌群失調(diào),引發(fā)其他病癥,同時(shí)還導(dǎo)致了HP耐藥性逐步增強(qiáng),根除率逐年降低。因此,研究HP化學(xué)生物學(xué)調(diào)控新機(jī)制和發(fā)展抗HP新藥具有重要科學(xué)意義和轉(zhuǎn)化價(jià)值。
上海交通大學(xué)醫(yī)學(xué)院張良研究員等課題組于2021年11月26日在Nature Communications在線發(fā)表研究論文,題目為“Helicobacter pylori FabX contains a [4Fe-4S] cluster essential for unsaturated fatty acid synthesis”。該研究闡明了HP特有的脂肪酸脫氫異構(gòu)酶FabX對(duì)飽和脂肪酰修飾ACP底物的選擇性識(shí)別和催化調(diào)控的化學(xué)生物學(xué)機(jī)制,明確了HP不飽和脂肪酸合成與分泌ROS腐蝕胃黏膜病理功能之間的密切關(guān)聯(lián),為抗HP創(chuàng)新藥物研發(fā)提供了科學(xué)依據(jù)。
II型脂肪酸合成途徑(FAS-II)是細(xì)菌的主要基礎(chǔ)代謝途徑,其酶系是公認(rèn)的抗菌藥物靶標(biāo)群。底物載脂蛋白(Acyl Carrier Protein, ACP)為該途徑的核心,是脂肪酸底物的共價(jià)載體。ACP通過(guò)其保守絲氨酸側(cè)鏈共價(jià)修飾脂肪酰底物,并攜帶底物依次被該途徑中的七類酶識(shí)別并催化,從而完成對(duì)不飽和脂肪酸(Unsaturated Fatty Acid, UFA)和飽和脂肪酸(Saturated Fatty Acid, SFA)的合成。由于存在ACP脂肪酰共價(jià)修飾難以在體外構(gòu)建的技術(shù)瓶頸,該途徑酶系識(shí)別和催化調(diào)控ACP-脂肪酰底物的化學(xué)生物學(xué)機(jī)制一直不甚明確,制約了該領(lǐng)域發(fā)展和相關(guān)藥物研發(fā)。

研究團(tuán)隊(duì)首先發(fā)展了HP脂肪酸合成途徑底物載脂蛋白ACP與不同長(zhǎng)度脂肪酰底物的體外共價(jià)修飾技術(shù),并證明FabX對(duì)長(zhǎng)度為8碳和10碳的飽和脂肪酰底物具有選擇性脫氫催化活性。進(jìn)一步解析了FabX、FabX與磷脂酰泛酰修飾型ACP(holo-ACP),以及FabX與8碳飽和脂肪酰修飾型ACP(8C-ACP)的復(fù)合物晶體結(jié)構(gòu)。通過(guò)電子順磁共振技術(shù)(Electron paramagnanetic resonance, EPR)研究發(fā)現(xiàn),FabX利用位于活性中心FMN附近的氨基酸His182對(duì)飽和脂肪酰底物進(jìn)行親核攻擊,觸發(fā)脫氫催化反應(yīng)。更重要的是,FabX利用獨(dú)特的FMN和[4Fe-4S]鐵硫簇雙活性中心對(duì)脫氫產(chǎn)生的2對(duì)電子/質(zhì)子進(jìn)行往返傳遞和臨時(shí)儲(chǔ)存,并在反應(yīng)結(jié)束后將電子最終傳遞給穩(wěn)定在His182附近負(fù)氧離子洞中的氧氣分子,生成超氧分子,揭示了這種FMN-[4Fe-4S]雙活性中心之間電子往返傳遞和存儲(chǔ)的獨(dú)特分子機(jī)制。最后,HP通過(guò)將超氧分子快速排至胞外,促進(jìn)腐蝕胃黏膜的病理作用,闡明了脂肪酸合成與HP病理作用之間的密切關(guān)聯(lián)。該工作在審稿期間被審稿人高度評(píng)價(jià)為“This is a great contribution to the field of bacterial fatty acid biosynthesis”。
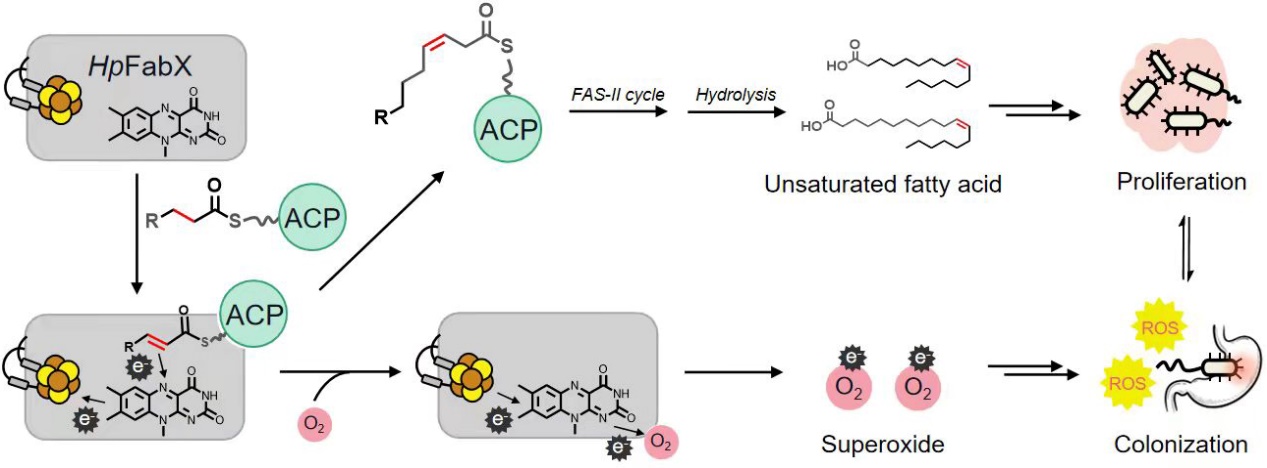
圖1 HP不飽和脂肪酸合成關(guān)鍵酶FabX的催化分子機(jī)制和功能
上海交通大學(xué)醫(yī)學(xué)院張良研究員、南京醫(yī)科大學(xué)畢洪凱教授、美國(guó)伊利諾伊大學(xué)香檳分校John E. Cornan教授和上海中醫(yī)藥大學(xué)陳紅專教授為該論文的共同通訊作者。上海交通大學(xué)醫(yī)學(xué)院20級(jí)博士生周甲申、博士后張琳、南京醫(yī)科大學(xué)實(shí)驗(yàn)師曾利平、中科院合肥強(qiáng)磁場(chǎng)中心于璐副研究員、南京醫(yī)科大學(xué)實(shí)驗(yàn)師段園園和上海交通大學(xué)醫(yī)學(xué)院16級(jí)碩士生沈思琪為該論文的共同第一作者。該工作受到了中國(guó)科學(xué)技術(shù)大學(xué)田長(zhǎng)麟教授、中國(guó)科學(xué)院深圳先進(jìn)技術(shù)研究院合成所周佳海研究員、復(fù)旦大學(xué)藥學(xué)院周璐教授、南京中醫(yī)藥大學(xué)張毅楠教授和上海交通大學(xué)醫(yī)學(xué)院附屬仁濟(jì)醫(yī)院林厚文教授的指導(dǎo)和大力支持,并受到了國(guó)家基金委重大研發(fā)計(jì)劃和面上項(xiàng)目、上海市科委和教委等項(xiàng)目的資助。