STING(Stimulator of interferon genes,干擾素基因刺激因子)是天然免疫過程中的重要調(diào)控分子,cGAS-STING通路可感知游離DNA并激活下游NF-κB和IRF3信號(hào)分子,產(chǎn)生Ⅰ型干擾素,對(duì)感染,自體免疫疾病,炎癥反應(yīng)及細(xì)胞衰老等過程均有重要作用 【1-5】。近年的研究也顯示STING介導(dǎo)了游離DNA或cGMAP引起的非經(jīng)典自噬過程,該過程往往不需要經(jīng)典自噬分子如ULK1 復(fù)合物或VPS34-Beclin1復(fù)合物的參與【6,7】。然而,目前對(duì)于STING在能量缺失誘導(dǎo)的經(jīng)典自噬通路中的功能仍不明確。
2022年5月5日,上海交通大學(xué)醫(yī)學(xué)院病理生理學(xué)系鐘清、留筱廈課題組聯(lián)合華中科技大學(xué)同濟(jì)醫(yī)學(xué)院病原生物學(xué)系榮岳光課題組及美國(guó)德州大學(xué)西南醫(yī)學(xué)中心Helmut Kramer團(tuán)隊(duì)在國(guó)際知名期刊 Journal of Cell Biology上發(fā)表了題為 STING controls energy stress-induced autophagy and energy metabolism via STX17的研究論文。在本研究中,研究者利用果蠅,小鼠和培養(yǎng)細(xì)胞體系,深入揭示了STING分子的激活可負(fù)調(diào)控能量缺失引起的自噬過程,其機(jī)制為STING可通過與自噬膜融合重要蛋白STX17結(jié)合,影響STX17蛋白從內(nèi)質(zhì)網(wǎng)運(yùn)輸?shù)酵暾允审w的轉(zhuǎn)運(yùn)過程,從而抑制自噬體-溶酶體融合效率并下調(diào)細(xì)胞自噬。該研究為揭示STING分子的非免疫功能,及其與自噬和能量代謝的關(guān)系提供了新的思路。

首先,研究團(tuán)隊(duì)通過對(duì)缺失STING的果蠅脂肪體細(xì)胞(fat body cells)中的自噬表型進(jìn)行分析,發(fā)現(xiàn)STING的缺失可引起自噬通量升高,自噬體與溶酶體融合速率加快,且通過對(duì)自噬膜融合關(guān)鍵分子STX17的雙重敲除實(shí)驗(yàn)推斷STING缺失引起的自噬通量增加極有可能是通過STX17發(fā)揮作用。隨后,研究者利用小鼠運(yùn)動(dòng)模型再次證明,在STING敲除的小鼠中,急性運(yùn)動(dòng)引起的自噬水平升高,自噬底物降解加劇,且運(yùn)動(dòng)引起的能量代謝關(guān)鍵分子AMPK(Adenosine 5‘-monophosphate (AMP)-activated protein kinase)激活水平增加。通過進(jìn)一步對(duì)AMPK分子底物激活的分析的和糖,脂代謝指標(biāo)的檢測(cè),證明STING缺失可能通過上調(diào)運(yùn)動(dòng)刺激下骨骼肌中AMPK活性,從而增加其下游TBC1D1 (TBC1 Domain Family Member 1)分子磷酸化水平及其所調(diào)控的葡萄糖轉(zhuǎn)運(yùn)分子GLUT4 (Glucose transporter type 4)向骨骼肌細(xì)胞質(zhì)膜上的轉(zhuǎn)運(yùn)過程,導(dǎo)致STING敲除小鼠骨骼肌細(xì)胞對(duì)血液中葡萄糖分子攝取水平顯著提升,運(yùn)動(dòng)能力增強(qiáng)。而STING的缺失并沒有影響到急性運(yùn)動(dòng)模型中小鼠體內(nèi)脂肪的代謝水平。該部分實(shí)驗(yàn)創(chuàng)新性地提出了STING對(duì)于自噬的負(fù)調(diào)控功能和對(duì)機(jī)體能量代謝的影響,那么在分子機(jī)制上STING又是怎樣作用于自噬過程的呢?接下來,研究者通過對(duì)STING缺失細(xì)胞的研究發(fā)現(xiàn),STING缺失可加速能量缺失誘導(dǎo)的自噬中的自噬體-溶酶體融合過程,且該功能依賴于經(jīng)典自噬途徑的調(diào)控蛋白,如STX17, ULK1/2, ATG14, ATG9A ATG5等。進(jìn)一步的分子機(jī)制研究顯示,駐留于內(nèi)質(zhì)網(wǎng)的STING分子可直接結(jié)合自噬膜融合關(guān)鍵蛋白復(fù)合體SNAREs中的重要成分STX17蛋白,阻止其轉(zhuǎn)運(yùn)至自噬體上,抑制了與SNAP29, VAMP8組裝成自噬SNARE復(fù)合物的過程。且STING-STX17之間的相互作用可被能量缺失干擾,證明饑餓引起的自噬確是通過STING-STX17在內(nèi)質(zhì)網(wǎng)上的相互作用控制自噬膜融合效率。
另外,近年對(duì)STX17的研究發(fā)現(xiàn)該分子不僅介導(dǎo)了自噬膜融合,也由于TBK1(TANK-binding kinase 1)對(duì)其的磷酸化,參與了自噬體初始結(jié)構(gòu)mPAS的形成過程【8】,那么STING-STX17相互作用是否影響了mPAS的形成呢?研究者發(fā)現(xiàn)被TBK1磷酸化后的STX17 pS202并不能與STING結(jié)合,并且更多地分布于DFCP1(Double FYVE-containing protein 1)標(biāo)記的初始自噬體結(jié)構(gòu);相反的,S202位點(diǎn)磷酸化失活形式的STX17則表現(xiàn)出與STING較好的相互作用,且分布于LC3+-LAMP2+ ( Lysosome-associated membrane glycoprotein 2)標(biāo)記的完整自噬體結(jié)構(gòu)。該部分實(shí)驗(yàn)指出STING可能作用于未被TBK1磷酸化的STX17蛋白,從而特異性地影響自噬體-溶酶體融合,而不作用于自噬體形成階段。接下來,研究者探究了STING-STX17相互作用是否會(huì)被cGAMP導(dǎo)致的STING激活水平影響。研究者發(fā)現(xiàn)STING-STX17的解離會(huì)發(fā)生于cGAMP激活STING分子或STING分子發(fā)生ER-ERGIC轉(zhuǎn)運(yùn)后,且與疾病相關(guān)的STING過激活形式表現(xiàn)出與STX17相互作用的增強(qiáng)及對(duì)自噬的抑制。并且,研究者發(fā)現(xiàn)STING C148位點(diǎn)是與STX17結(jié)合的關(guān)鍵作用位點(diǎn),在敲除細(xì)胞中回補(bǔ)STING C148位點(diǎn)的失活突變形式表現(xiàn)出了較弱的自噬抑制功能。該部分證明了STING的激活干擾了其與STX17的結(jié)合,且揭示了STING-STX17相互作用的生化機(jī)制。
最后,研究者發(fā)現(xiàn),STING-STX17作用軸與STING分子本身在PAMPs誘導(dǎo)的非經(jīng)典自噬途徑中是相互獨(dú)立的,表現(xiàn)為HT-DNA誘導(dǎo)下STX17與STING解離后分布于不同的自噬相關(guān)結(jié)構(gòu),且STX17的敲除不影響STING分子的降解和轉(zhuǎn)運(yùn)過程。
本研究表明,在營(yíng)養(yǎng)充足和先天免疫未被激活的環(huán)境中,STING分子可通過與自噬膜融合重要蛋白STX17結(jié)合,使其駐留在內(nèi)質(zhì)網(wǎng)中,從而抑制了STX17參與的自噬體-溶酶體融合過程,下調(diào)了自噬通量。在STING缺失,或被cGAMP激活,及發(fā)生內(nèi)質(zhì)網(wǎng)-ERGIC轉(zhuǎn)運(yùn)時(shí),STX17被STING釋放,導(dǎo)致自噬水平上調(diào),從而增強(qiáng)了運(yùn)動(dòng)狀態(tài)下機(jī)體糖代謝水平和運(yùn)動(dòng)能力。總之,該研究揭示了全新的STING非免疫功能,即對(duì)能量缺失引起的經(jīng)典自噬通路的空間調(diào)控作用,提示了先天免疫與能量代謝之間的新關(guān)聯(lián)。
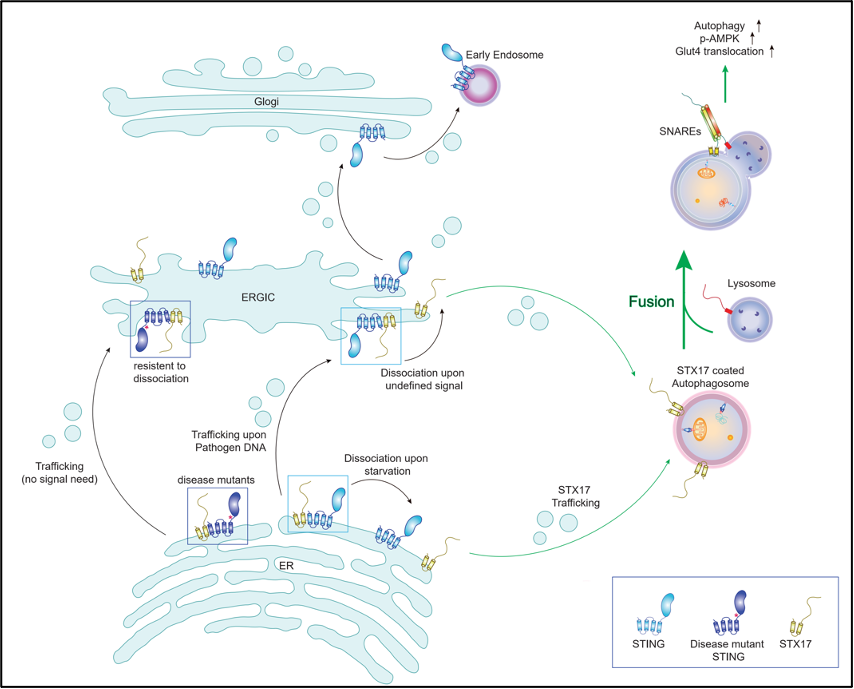
圖文摘要
華中科技大學(xué)同濟(jì)醫(yī)學(xué)院榮岳光教授,上海交通大學(xué)醫(yī)學(xué)院助理研究員張燊博士,德州大學(xué)西南醫(yī)學(xué)中心Nilay Nandi博士以及華中科技大學(xué)同濟(jì)醫(yī)學(xué)院博士研究生吳哲為該論文的共同第一作者,上海交通大學(xué)醫(yī)學(xué)院鐘清研究員,華中科技大學(xué)同濟(jì)醫(yī)學(xué)院榮岳光教授,德州大學(xué)西南醫(yī)學(xué)中心 Helmut Kramer教授及上海交通大學(xué)醫(yī)學(xué)院留筱廈副研究員為該論文的共同通訊作者。
原文鏈接: https://rupress.org/jcb/article-abstract/221/7/e202202060/213198/STING-controls-energy-stress-induced-autophagy-and?redirectedFrom=fulltext
參考文獻(xiàn)
1. Cai, Xin, Yu-Hsin Chiu, and Zhijian J. Chen. "The cGAS-cGAMP-STING pathway of cytosolic DNA sensing and signaling." Molecular cell 54.2 (2014): 289-296.
2. Ishikawa, Hiroki, and Glen N. Barber. "STING is an endoplasmic reticulum adaptor that facilitates innate immune signalling." Nature 455.7213 (2008): 674-678.
3. Jin, Lei, et al. "MPYS, a novel membrane tetraspanner, is associated with major histocompatibility complex class II and mediates transduction of apoptotic signals." Molecular and cellular biology 28.16 (2008): 5014-5026.
4. Sun, Wenxiang, et al. "ERIS, an endoplasmic reticulum IFN stimulator, activates innate immune signaling through dimerization." Proceedings of the National Academy of Sciences 106.21 (2009): 8653-8658.
5. Zhong, Bo, et al. "The adaptor protein MITA links virus-sensing receptors to IRF3 transcription factor activation." Immunity 29.4 (2008): 538-550.
6. Gui, Xiang, et al. "Autophagy induction via STING trafficking is a primordial function of the cGAS pathway." Nature 567.7747 (2019): 262-266.
7. Liu, Dong, et al. "STING directly activates autophagy to tune the innate immune response." Cell Death & Differentiation 26.9 (2019): 1735-1749.
8. Kumar, Suresh, et al. "Phosphorylation of syntaxin 17 by TBK1 controls autophagy initiation." Developmental cell 49.1 (2019): 130-144.