10月19日,上海交通大學(xué)醫(yī)學(xué)院上海市免疫學(xué)研究所鄒強(qiáng)研究團(tuán)隊(duì)等在Cell Metabolism雜志在線發(fā)表了題為“Dietary fructose-mediated adipocyte metabolism drives antitumor CD8+ T cell responses”的研究論文。該研究揭示了一條免疫內(nèi)分泌通路:果糖-脂肪細(xì)胞-瘦素- CD8+ T細(xì)胞軸,描述了膳食果糖在塑造脂肪細(xì)胞代謝以啟動(dòng)抗腫瘤CD8+ T細(xì)胞反應(yīng)中的關(guān)鍵作用,提示該免疫內(nèi)分泌通路潛在的癌癥免疫治療方案可能性。

攝入糖類(lèi)能促進(jìn)人體大腦中的多巴胺分泌,故而攝入糖類(lèi)含量高的食物能使人感到更快樂(lè)[1]。近年來(lái),果葡糖漿、高果糖玉米糖漿類(lèi)調(diào)味劑的使用量大大增加。果糖是葡萄糖的一種同分異構(gòu)體,個(gè)人日常所攝入果糖總量的40~60%來(lái)源于水果、蜂蜜以及蔗糖;另一主要來(lái)源是由淀粉水解為葡萄糖后,葡萄糖通過(guò)多元醇途徑轉(zhuǎn)化為果糖。
多項(xiàng)研究發(fā)現(xiàn),果糖的過(guò)量攝入與肥胖、糖尿病和脂肪肝等代謝性疾病密切相關(guān)[2]。對(duì)于腫瘤發(fā)生發(fā)展,近日國(guó)內(nèi)研究團(tuán)隊(duì)證實(shí)了高果糖在小鼠模型中能促進(jìn)肝癌進(jìn)展[3];也有團(tuán)隊(duì)揭示了在小鼠模型中,果糖代謝可促進(jìn)腸道腫瘤發(fā)生肝轉(zhuǎn)移[4]。以上研究揭示了果糖對(duì)于腫瘤細(xì)胞生長(zhǎng)的促進(jìn)作用,但是果糖對(duì)腫瘤微環(huán)境中分子、代謝及免疫特性的影響仍有待確定。在本研究中,研究團(tuán)隊(duì)通過(guò)構(gòu)建高果糖飼喂模型,并向小鼠接種皮下腫瘤發(fā)現(xiàn),果糖飼喂組小鼠腫瘤生長(zhǎng)更緩慢,且小鼠生存時(shí)間顯著延長(zhǎng)。這與之前廣泛認(rèn)為的“果糖促癌”的觀點(diǎn)相反,果糖甚至可以抑制小鼠皮下腫瘤生長(zhǎng)。
結(jié)合單細(xì)胞測(cè)序、多種敲除鼠模型以及大數(shù)據(jù)分析,研究團(tuán)隊(duì)發(fā)現(xiàn)在高果糖飲食抑制小鼠皮下瘤生長(zhǎng)的背后,是CD8+ T細(xì)胞在其中發(fā)揮了關(guān)鍵作用。其研究結(jié)果顯示,在果糖飼喂下,小鼠腫瘤微環(huán)境中的CD8+ T細(xì)胞耗竭減少,增殖更多,且細(xì)胞因子IFNg分泌增多了。但是在T細(xì)胞上特異性敲除果糖轉(zhuǎn)運(yùn)蛋白GLUT5后,果糖飼喂組小鼠依然展現(xiàn)出更緩慢的腫瘤生長(zhǎng)速度以及更強(qiáng)勁的CD8+ T細(xì)胞抗腫瘤能力。研究團(tuán)隊(duì)通過(guò)蛋白芯片對(duì)血清中炎癥相關(guān)蛋白進(jìn)行分析發(fā)現(xiàn),關(guān)鍵在于一種脂肪因子——瘦素的含量發(fā)生了改變。果糖通過(guò)誘導(dǎo)了脂肪細(xì)胞中mTORC1依賴(lài)性瘦素的產(chǎn)生,增加了小鼠血清和腫瘤微環(huán)境中瘦素的水平,這是研究團(tuán)隊(duì)觀察到的果糖飼喂下小鼠抗腫瘤免疫增強(qiáng)的關(guān)鍵。
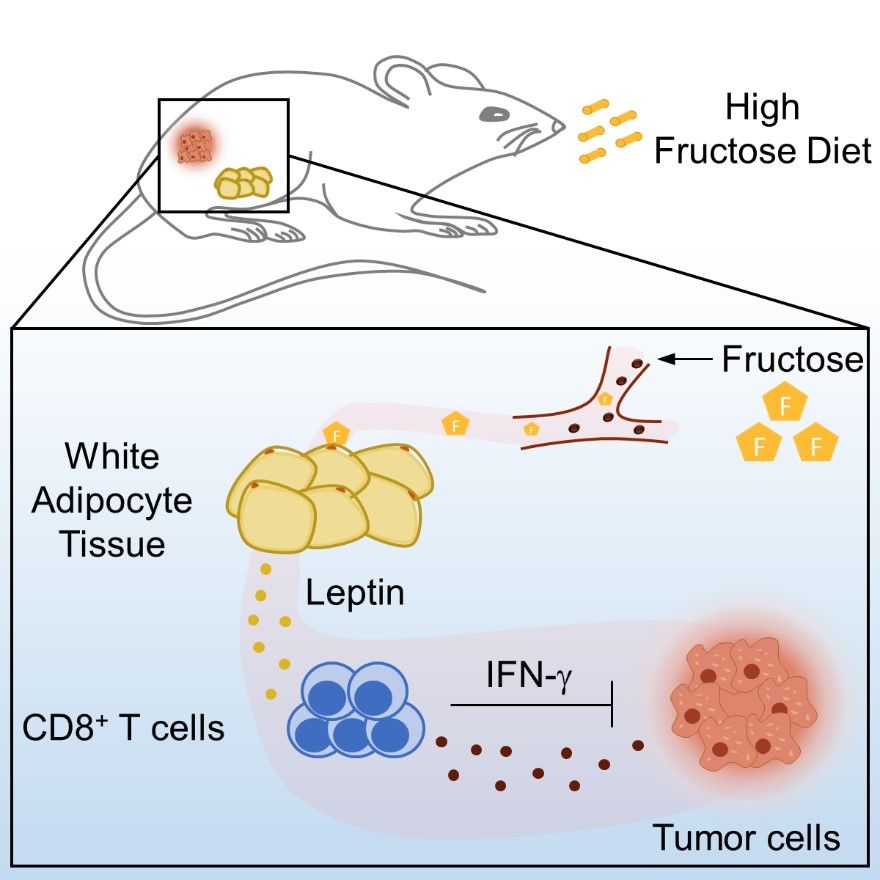
研究團(tuán)隊(duì)進(jìn)一步從肺癌患者腫瘤樣本和血液樣本中發(fā)現(xiàn),肺癌患者血漿中果糖濃度與瘦素水平呈正相關(guān),且血漿中瘦素水平和腫瘤微環(huán)境內(nèi)抗腫瘤CD8+ T細(xì)胞功能提升相關(guān)。
本項(xiàng)目是由上海交通大學(xué)醫(yī)學(xué)院上海市免疫學(xué)研究所鄒強(qiáng)團(tuán)隊(duì)、上海交通大學(xué)醫(yī)學(xué)院附屬上海市胸科醫(yī)院孫加源團(tuán)隊(duì)、上海交通大學(xué)醫(yī)學(xué)院附屬瑞金醫(yī)院趙任團(tuán)隊(duì)和上海交通大學(xué)醫(yī)學(xué)院上海市免疫學(xué)研究所葉幼瓊團(tuán)隊(duì)合作完成。文章共同第一作者為上海交通大學(xué)醫(yī)學(xué)院上海市免疫學(xué)研究所博士生張?jiān)麻拧⒏毖芯繂T于曉彥和技術(shù)員包汝娟。
1. Edwin Thanarajah, S., et al., Habitual daily intake of a sweet and fatty snack modulates reward processing in humans. Cell Metab, 2023. 35(4): p. 571-584 e6.
2. Febbraio, M.A. and M. Karin, "Sweet death": Fructose as a metabolic toxin that targets the gut-liver axis. Cell Metab, 2021. 33(12): p. 2316-2328.
3. Zhou, P., et al., High dietary fructose promotes hepatocellular carcinoma progression by enhancing O-GlcNAcylation via microbiota-derived acetate. Cell Metab, 2023.
4. Bu, P., et al., Aldolase B-Mediated Fructose Metabolism Drives Metabolic Reprogramming of Colon Cancer Liver Metastasis. Cell Metab, 2018. 27(6): p. 1249-1262 e4.