近日,上海交通大學醫(yī)學院基礎醫(yī)學院藥理學與化學生物學系高小玲教授聯(lián)合上海中醫(yī)藥大學陳紅專教授和加拿大多倫多大學鄭崗教授在國際權威雜志《自然.納米技術》(Nature Nanotechnology)正式發(fā)表了題為“Intracerebral fate of organic and inorganic nanoparticles is dependent on microglial extracellular vesicle function”的研究論文。《自然.納米技術》同期配發(fā)《Intracerebral fate of engineered nanoparticles》新聞和評述。

納米遞藥技術的快速發(fā)展為疾病診療帶來了革命性進展,但對腦部疾病的診療仍面臨巨大挑戰(zhàn)。既往研究多聚焦于各種納米遞藥系統(tǒng)跨血腦屏障藥物遞送效率和效應,而對于入腦后納米遞藥系統(tǒng)的腦內(nèi)轉(zhuǎn)運和清除模式(腦內(nèi)命運)等缺乏了解,極大限制了納米遞藥系統(tǒng)的有效安全應用的拓展。一方面,納米遞藥系統(tǒng)為藥物的高效腦內(nèi)靶向遞送并診治疾病提供更多機會;另一方面,納米遞藥系統(tǒng)本身在腦內(nèi)的過量蓄積亦可能引起不可逆轉(zhuǎn)的中樞神經(jīng)系統(tǒng)(CNS)潛在毒副作用。因此,深入探討納米遞藥系統(tǒng)入腦后的命運決定機制及其調(diào)控方案將為其安全應用提供重要依據(jù)和保障,具有重要的理論價值和現(xiàn)實意義。
高小玲課題組長期聚焦CNS的藥物遞送研究,特別關注遞藥技術的高效性和安全性,在國際上率先開展了納米遞藥系統(tǒng)的腦內(nèi)命運和清除機制研究。該研究發(fā)現(xiàn)有機材料構成的重組高密度脂蛋白和聚乙二醇-聚乳酸納米粒可經(jīng)過膠質(zhì)淋巴系統(tǒng)途徑向腦外快速清除;而金納米粒、量子點、氧化鐵納米顆粒等無機納米粒的腦清除過程緩慢,存在腦內(nèi)蓄積和引發(fā)神經(jīng)毒性的風險。小膠質(zhì)細胞是CNS常駐巨噬細胞,在清除異物,維持腦內(nèi)穩(wěn)態(tài)發(fā)揮重要作用。小膠質(zhì)細胞攝取有機納米粒后,將其轉(zhuǎn)運至血管旁,使其通過膠質(zhì)淋巴系統(tǒng)向腦外清除;而無機納米粒被小膠質(zhì)細胞捕獲后,長時間滯留于胞內(nèi),無法外排。
為了揭示小膠質(zhì)細胞介導不同材料納米粒腦內(nèi)轉(zhuǎn)運和清除差異的機制,研究人員分析比較了小膠質(zhì)細胞內(nèi)各納米粒的分布、轉(zhuǎn)運與外排方式,并采用轉(zhuǎn)錄組學等系統(tǒng)生物學方法比較各種納米粒對細胞生物學過程和關鍵信號通路的影響。發(fā)現(xiàn)有機、無機種類納米粒處理后,小膠質(zhì)細胞內(nèi)與胞內(nèi)囊泡轉(zhuǎn)運、細胞外囊泡(EVs)發(fā)生和釋放等過程密切相關的細胞外信號調(diào)節(jié)激酶(ERK1/2)信號通路發(fā)生了不同方向的變化:無機納米粒處理抑制小膠質(zhì)細胞的ERK1/2通路,EVs分泌減少;而有機納米粒促進小膠質(zhì)細胞ERK1/2通路激活,胞內(nèi)囊泡轉(zhuǎn)運增加,EVs分泌增加。而抑制EVs分泌,顯著減少納米粒從小膠質(zhì)細胞外排,抑制其腦內(nèi)轉(zhuǎn)運和清除。以上結果表明,小膠質(zhì)細胞的EVs分泌可能是其介導納米粒腦內(nèi)轉(zhuǎn)運和清除的關鍵機制,相關途徑受ERK1/2信號通路調(diào)控。
為實現(xiàn)納米遞藥系統(tǒng)的腦內(nèi)命運調(diào)控,研究人員進一步提出通過藥理學手段激活ERK1/2通路,促進小膠質(zhì)細胞以EVs分泌方式促進納米粒從腦實質(zhì)轉(zhuǎn)運至血管旁清除,從而減少腦內(nèi)納米粒的腦內(nèi)蓄積。研究發(fā)現(xiàn)ERK1/2激動劑帕莫酸處理后,小膠質(zhì)細胞分泌的EVs數(shù)量顯著增多,且在EVs伴隨包裹大量QD和AuNP。重要的是,在帕莫酸共注射情況下,量子點和金納米粒的腦清除速率分別提高至原來的5.48倍和28.56倍。小膠質(zhì)細胞耗竭和膠質(zhì)淋巴系統(tǒng)抑制實驗證實帕莫酸促進的無機納米粒腦清除同樣是通過小膠質(zhì)細胞介導的膠質(zhì)淋巴系統(tǒng)途徑實現(xiàn)的。
綜上所述,該研究通過闡明不同納米遞藥系統(tǒng)腦清除差異的原因,揭示小膠質(zhì)細胞EVs對于腦內(nèi)納米粒的清除至關重要;發(fā)現(xiàn)通過激活ERK1/2通路,可促進小膠質(zhì)細胞EVs的釋放,有效減輕納米粒特別是具有神經(jīng)毒性的無機納米粒的腦內(nèi)蓄積。以上發(fā)現(xiàn)填補了納米遞藥系統(tǒng)的腦內(nèi)命運調(diào)控領域研究的空白,同時為納米遞藥系統(tǒng)的腦內(nèi)安全應用提供了重要的理論和實驗基礎。
上海交通大學醫(yī)學院高金超博士為該論文的第一作者,高小玲教授、上海中醫(yī)藥大學陳紅專教授和加拿大多倫多大學鄭崗教授為共同通訊作者。該工作得到了國家自然科學基金、國家重點研發(fā)計劃、上海市科委、上海市科委項目的資助。上海交通大學醫(yī)學院基礎醫(yī)學公共技術平臺和上海交通大學分析測試中心提供了重要的設備和技術支持。
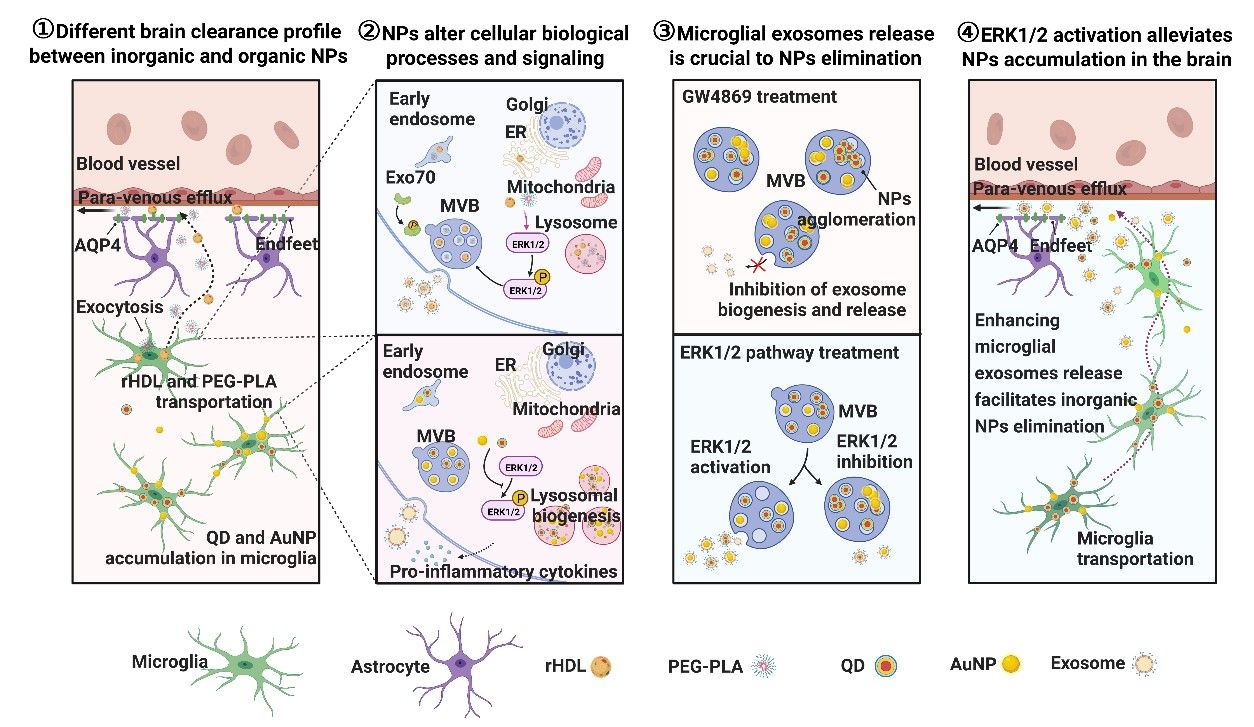
小膠質(zhì)細胞介導的腦內(nèi)納米粒轉(zhuǎn)運和清除機制研究。①有機和無機納米粒腦內(nèi)清除動力學存在差異。rHDL和PEG-PLA被小膠質(zhì)細胞轉(zhuǎn)運至血管旁經(jīng)膠質(zhì)淋巴系統(tǒng)向腦外清除,QD和AuNP被小膠質(zhì)細胞攝取,極少分布于腦血管旁區(qū)域。②不同納米粒改變小膠質(zhì)細胞的生物學過程和信號通路。③小膠質(zhì)細胞EVs的釋放是胞內(nèi)納米粒消除的關鍵。抑制EVs生成和釋放,納米粒大量蓄積于小膠質(zhì)細胞;促進EVs生成和釋放,胞內(nèi)納米粒清除增加。④EKR1/2激活能減少腦內(nèi)納米粒的蓄積。通過激活ERK1/2通路增加小膠質(zhì)細胞外泌體的釋放,促進轉(zhuǎn)運后納米粒的外排,最后經(jīng)膠質(zhì)淋巴系統(tǒng)途徑清除。
論文鏈接:Intracerebral fate of organic and inorganic nanoparticles is dependent on microglial extracellular vesicle function | Nature Nanotechnology