近日,國際知名雜志ACS Catalysis (IF=12.221)在線發(fā)表了基礎(chǔ)醫(yī)學(xué)院張健等針對Ras蛋白的題為Deactivation Pathway of Ras GTPase Underlies Conformational Substates as Targets for Drug Design的研究論文,他們通過揭示Ras蛋白生物催化水解底物失活的動態(tài)過程,闡明了Ras動態(tài)過程中的中間失活構(gòu)象,基于此發(fā)現(xiàn)了一個全新的隱式變構(gòu)位點(Hidden Allosteric Site),為后續(xù)靶向Ras蛋白的藥物設(shè)計開辟了新的途徑。
Ras是著名的癌基因,它的突變會在超過30%的癌癥中發(fā)生,而突變引起的Ras蛋白的異常激活也和癌癥發(fā)病過程緊密相關(guān)。一直以來,人們對于Ras蛋白從激活到失活的轉(zhuǎn)變的動態(tài)過程了解尚淺,對于Ras蛋白的結(jié)構(gòu)研究也一直乏善可陳,雖然前期已經(jīng)有多類靶向Ras蛋白的抑制劑被開發(fā),但是它們無一能夠最終被應(yīng)用到臨床上針對Ras蛋白介導(dǎo)的癌癥的治療當(dāng)中,因此,Ras蛋白也一直被認為是不可成藥的(undruggable)。
為了進一步探索在Ras蛋白上進行藥物開發(fā)的可能性,研究者決定從它水解失活這一動態(tài)過程入手。利用基于Nudged Elastic Band方法的大規(guī)模分子動力學(xué)模擬以及馬爾可夫鏈分析,他們發(fā)現(xiàn)了在Ras水解的通路上存在多個亞狀態(tài)(substates)(圖一)。
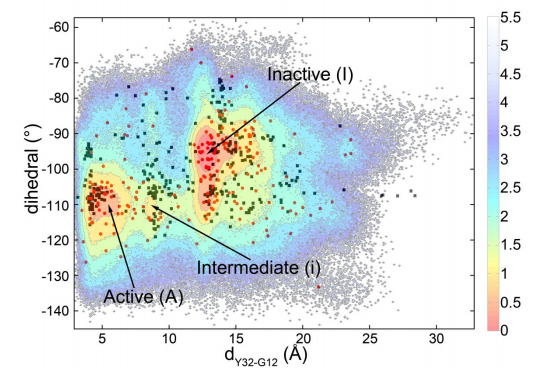
基于這些亞狀態(tài)以及結(jié)構(gòu)分析,研究人員提出了,Ras蛋白的失活過程將會是一個分步過程,即,水解的過程中,首先Ras蛋白中的SW1結(jié)構(gòu)域發(fā)生擺動,與底物GTP之間的相互作用被破壞;隨后進一步SW2結(jié)構(gòu)域再發(fā)生擺動,與底物GTP之間的相互作用受影響。經(jīng)歷了上述兩個分步的過程后,最終原本結(jié)合的GTP會被水解成為GDP,完成蛋白的水解失活過程(圖二)。

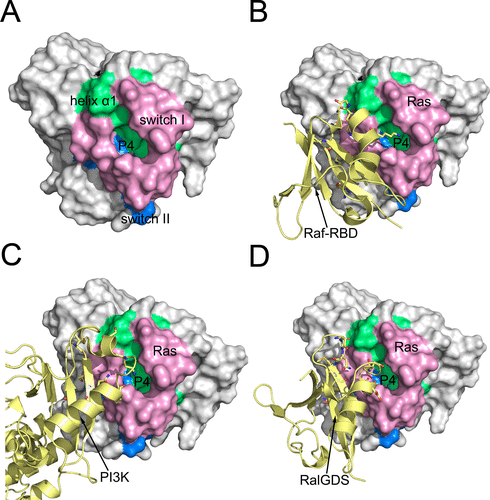
隨后,基于上述所發(fā)現(xiàn)的一系列亞狀態(tài)的結(jié)構(gòu),他們對其進行了隱藏在蛋白內(nèi)部的變構(gòu)藥物位點(隱式變構(gòu)位點)識別,并發(fā)現(xiàn)了一個全新的隱式變構(gòu)位點P4(T20, I21,Q25, E31, I36, D38, I55)。該位點不僅會對于Ras蛋白自身的GTP酶酶活具有調(diào)節(jié)作用,并且還位于Ras蛋白和一系列效應(yīng)蛋白(effector)相互作用的界面上(圖三)。而利用突變實驗,他們進一步闡明了這個位點的變構(gòu)調(diào)節(jié)效應(yīng),證實了該位點對于Ras蛋白特異性的變構(gòu)調(diào)節(jié)作用。該位點的發(fā)現(xiàn)將為后續(xù)針對Ras蛋白的變構(gòu)藥物開發(fā)提供指導(dǎo),并且也為針對Ras與下游效應(yīng)蛋白的蛋白相互作用調(diào)節(jié)劑的藥物設(shè)計提供理論依據(jù)。
該研究以Ras蛋白為例,系統(tǒng)提出了在蛋白結(jié)構(gòu)表面無變構(gòu)位點情況下,如何發(fā)現(xiàn)“隱式變構(gòu)位點”的方案,不僅為Ras提供了未來藥物研發(fā)的新位點,也為更多此前被認為難成藥靶標(biāo)的變構(gòu)藥物設(shè)計提供了全新思路和經(jīng)典案例。本工作第一作者為上海交通大學(xué)醫(yī)學(xué)院陸紹永副教授、倪端(本科生)和王承祥(博士生),課題受到國家自然基金重大研究計劃、科技部重大項目及重大新藥創(chuàng)制等多個項目的資助。
原文鏈接:https://pubs.acs.org/doi/10.1021/acscatal.9b02556