日前,生物化學(xué)與分子細(xì)胞生物學(xué)系黃建教授等在Oncogene雜志發(fā)表了 “Glucose-mediated N-glycosylation of RPTPα affects its subcellular localization and Src activation”的研究論文。
蛋白質(zhì)酪氨酸磷酸酶通過酪氨酸去磷酸化調(diào)控,在癌癥相關(guān)的諸多細(xì)胞過程中發(fā)揮著重要作用。受體型蛋白質(zhì)酪氨酸磷酸酶 α(RPTPα)是典型的 PTP 之一,作為 Src 激酶的調(diào)節(jié)分子,其通過對 Src C-末端527 位酪氨酸去磷酸化激活 Src,進(jìn)而促進(jìn)腫瘤的發(fā)生發(fā)展,因而 RPTPα被認(rèn)為是促癌基因。
? 蛋白質(zhì)翻譯后修飾(PTM)提供了蛋白質(zhì)的多樣性,是進(jìn)一步改變蛋白質(zhì)功能的關(guān)鍵機(jī)制。糖基化是最普遍的蛋白質(zhì)翻譯后修飾形式之一,細(xì)胞內(nèi)50%的蛋白質(zhì)都存在糖基化修飾,其中以N-糖基化和O-糖基化修飾最為普遍。
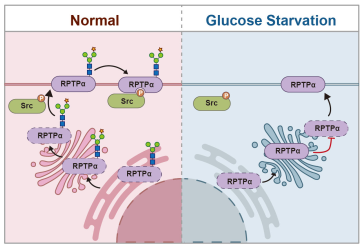
在此項(xiàng)工作中,研究者發(fā)現(xiàn)RPTPα在腫瘤中存在高度的N-糖基化修飾,并鑒定了位于胞外段的7個(gè)N-糖基化位點(diǎn)。進(jìn)一步的功能研究發(fā)現(xiàn),葡萄糖饑餓可以特異抑制RPTPα的N-糖基化修飾而不影響其O-糖基化修飾;非N-糖基化的RPTPα?xí)嗟臏粼诟郀柣髦校5腘-糖基化修飾的RPTPα則更多的定位在細(xì)胞質(zhì)膜,并在近膜端與Src相互作用,進(jìn)而激活Src激酶,并最終促進(jìn)腫瘤的發(fā)生發(fā)展。此外,研究者還證實(shí)N-糖基化修飾并不影響RPTPα的蛋白穩(wěn)定性、磷酸酶活性、其789位酪氨酸磷酸化水平及細(xì)胞膜上RPTPα二聚體的形成。總之。本研究首次精確鑒定了RPTPα N-糖基化修飾位點(diǎn),并從新的角度提出了糖基化修飾在RPTPα促癌功能中的作用機(jī)制,為RPTPα以及膜蛋白的腫瘤研究提供了一些新的依據(jù)。
上海交通大學(xué)醫(yī)學(xué)院生物化學(xué)與分子細(xì)胞生物學(xué)系碩士生方嘉鈺和張宇琴為本論文共同第一作者,上海交通大學(xué)醫(yī)學(xué)院黃建教授和余健秀研究員為本論文共同通訊作者,本研究工作得到了國家自然科學(xué)基金的資助。
原文鏈接:
https://pubmed.ncbi.nlm.nih.gov/36765146/