決定細(xì)胞命運(yùn)的關(guān)鍵因素之一是細(xì)胞對(duì)過量活性氧(ROS)氧化應(yīng)激的反應(yīng)。廣泛的脂質(zhì)過氧化通過一種稱為鐵死亡的獨(dú)特方式導(dǎo)致細(xì)胞發(fā)生死亡。鐵死亡(ferroptosis)作為一種鐵離子依賴的新型細(xì)胞程序性死亡,以鐵穩(wěn)態(tài)(iron homeostasis)的破壞和脂質(zhì)活性氧(reactive oxygen species, ROS)的積累為主要特征。現(xiàn)有的研究證明,鐵死亡廣泛參與氧化應(yīng)激引起的多種相關(guān)疾病,包括缺血再灌注損傷和神經(jīng)退行性疾病等。然而,調(diào)節(jié)細(xì)胞命運(yùn)應(yīng)對(duì)不同ROS的分子機(jī)制仍然不完全清楚。
2024年9月24日,上海交通大學(xué)醫(yī)學(xué)院病理生理學(xué)系鐘清課題組聯(lián)合張晶課題組以及上海交通大學(xué)醫(yī)學(xué)院附屬仁濟(jì)醫(yī)院牟姍團(tuán)隊(duì)在國際知名期刊PNAS上發(fā)表了題為RIPK4 promotes oxidative stress and ferroptotic death through the downregulation of ACSM1的研究論文。在本研究中,研究人員系統(tǒng)深入地解析了受體相互作用蛋白激酶RIPK4在氧化應(yīng)激壞死和鐵死亡中的作用,并為臨床上緩解急性腎損傷提供新的思路。
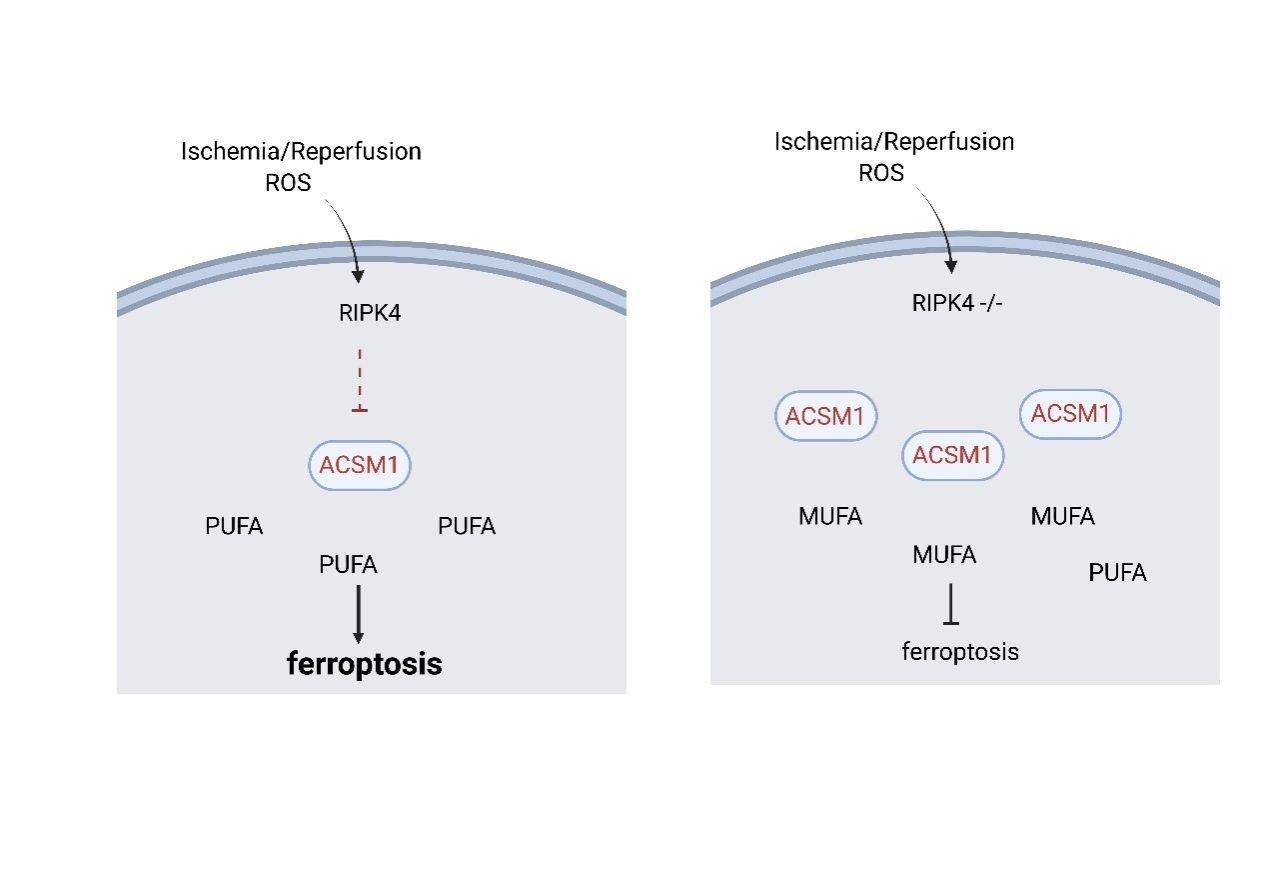
在本研究中,研究人員通過分析針對(duì)人類受體相互作用蛋白激酶(RIPK)家族成員的siRNA篩選,發(fā)現(xiàn)RIPK4對(duì)氧化應(yīng)激和鐵死亡至關(guān)重要。緊接著,研究人員構(gòu)建了RIPK4的CRISPR敲除細(xì)胞和過表達(dá)細(xì)胞,用不同的氧化應(yīng)激壞死和鐵死亡的誘導(dǎo)劑處理這些細(xì)胞,明確了RIPK4在氧化應(yīng)激壞死和鐵死亡中的作用;在動(dòng)物模型上,腎近端小管中RIPK4的特異性敲除可保護(hù)小鼠免受順鉑和腎缺血/再灌注引起的急性腎損傷。在機(jī)制研究中, 研究人員通過RNA測(cè)序發(fā)現(xiàn),順鉑治療誘導(dǎo)的酰基輔酶A合成酶中鏈(ACSM)家族成員的表達(dá)顯著降低,而在RIPK4缺陷小鼠中基本沒有影響。在這些ACSM家族成員中,抑制ACSM1會(huì)劇烈增強(qiáng)氧化應(yīng)激和鐵死亡的發(fā)生。同時(shí),脂質(zhì)組學(xué)分析表明,ACSM1的過表達(dá)導(dǎo)致單不飽和脂肪酸(MUFA)的積累,減少多不飽和脂肪酸(PUFA)的產(chǎn)生,從而使得細(xì)胞對(duì)鐵死亡抵抗。因此,敲除ACSM1會(huì)使RIPK4 KO細(xì)胞對(duì)氧化應(yīng)激和鐵死亡重新敏感。總之,RIPK4是參與氧化應(yīng)激和鐵死亡的重要因素,RIPK4-ASCM1軸揭示了氧化應(yīng)激誘導(dǎo)壞死和鐵死亡的新機(jī)制。
上海交通大學(xué)醫(yī)學(xué)院張晶博士,上海交通大學(xué)醫(yī)學(xué)院附屬仁濟(jì)醫(yī)院2018級(jí)致遠(yuǎn)計(jì)劃博士生韋月韓,上海交通大學(xué)醫(yī)學(xué)院岳揚(yáng)波和焦慧科博士為該論文的共同第一作者,上海交通大學(xué)醫(yī)學(xué)院鐘清教授,張晶研究員以及上海交通大學(xué)醫(yī)學(xué)院附屬仁濟(jì)醫(yī)院牟姍教授為該論文的共同通訊作者。本研究得到了國家科技部重點(diǎn)研發(fā)計(jì)劃,國家自然科學(xué)基金委重大研究計(jì)劃、國家自然科學(xué)基金面上項(xiàng)目,上海市衛(wèi)健委項(xiàng)目等多項(xiàng)資金的資助。