小細胞肺癌(SCLC)是一種侵襲性最強、致死率最高的肺癌亞型,約占肺癌病例的14%,全球每年約25萬人患病,死亡高達20萬。80-85%的患者在就診時既已出現(xiàn)廣泛轉(zhuǎn)移,因此,以鉑類藥物為主的化療是SCLC治療的主要手段。SCLC患者早期往往對于化療比較敏感,但絕大部分患者最終都會復(fù)發(fā),中位生存時間僅7~10個月,5年生存率僅6.2%。
腫瘤干樣細胞(CSLCs)是導(dǎo)致SCLC化療耐藥和腫瘤復(fù)發(fā)的根本原因。干細胞通過對稱分裂和不對稱分裂的方式實現(xiàn)動態(tài)平衡。干細胞不對稱分裂產(chǎn)生一個干細胞和一個分化細胞,以此維持干性;對稱分裂可產(chǎn)生兩個干細胞,以應(yīng)對發(fā)育或損傷修復(fù)過程中細胞大量增殖的需求。研究發(fā)現(xiàn)在放療和化療等應(yīng)激狀態(tài)下,CSLCs會從不對稱分裂轉(zhuǎn)換成對稱分裂模式,致使治療后CSLCs擴增并導(dǎo)致腫瘤耐藥和復(fù)發(fā)。但其調(diào)控機制仍不清楚。
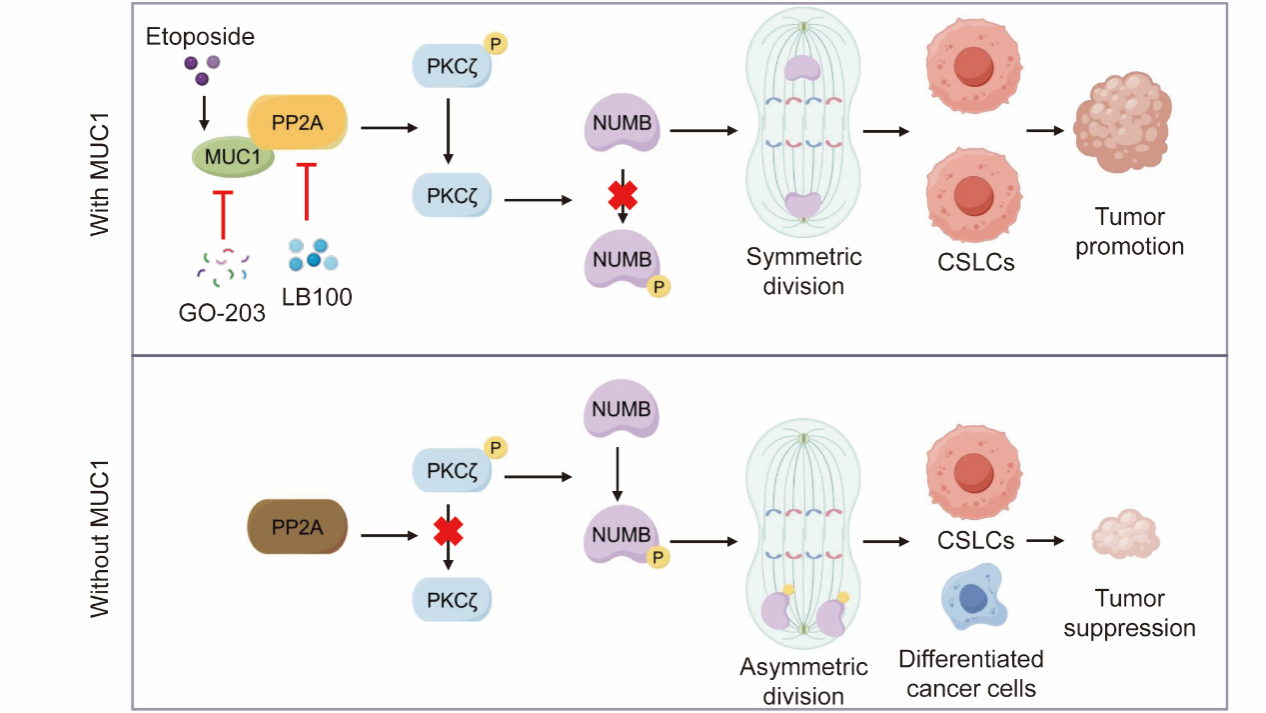
2025年5月12日,上海交通大學醫(yī)學院組織胚胎與遺傳發(fā)育學系黃雷課題組聯(lián)合中南大學附屬湘雅醫(yī)院胡成平團隊在國際知名期刊Advanced Science上發(fā)表了題為PP2A Promotes the Symmetric Division of MUC1-Dominant Cancer Stem-Like Cells in Small Cell Lung Cancer的研究論文。在該研究中,研究人員系統(tǒng)深入地解析了MUC1-PP2A通過切換對稱分裂而喚醒CSLCs擴增的新機制,為MUC1陽性SCLC的治療提供了新的思路和策略。
在該研究中,研究人員發(fā)現(xiàn)重要腫瘤標志物黏蛋白1(MUC1)在SCLC中高表達,并與患者預(yù)后不良相關(guān)。進一步分析發(fā)現(xiàn)MUC1在細胞周期的G2/M期的高表達并促進了SCLC中CSLC的對稱分裂和擴增。通過KEGG分析、免疫共沉淀質(zhì)譜分析以及GO分析篩選,發(fā)現(xiàn)參與細胞中期調(diào)控的蛋白磷酸酶2A(PP2A)。在機制研究中,研究人員發(fā)現(xiàn),MUC1與PP2A相互作用并增強了PP2A的活性,進一步利用磷酸化芯片發(fā)現(xiàn)PP2A通過抑制PKCζ的活性,最終降低了NUMB的磷酸化。NUMB磷酸化的減少促進了CSLC的對稱分裂,從而使CSLC數(shù)量增加。當用依托泊甙治療細胞時,發(fā)現(xiàn)MUC1-PP2A-PKCζ-NUMB信號通路被激活,同時出現(xiàn)CSLCs擴增和耐藥。而利用抑制劑或基因敲除等策略抑制MUC1/PP2A信號,則可有效抑制CSLCs擴增,增強SCLC細胞和移植瘤對依托泊甙的敏感性。此外,研究人員還利用臨床腫瘤組織驗證了MUC1-PP2A-PKCζ-NUMB信號通路的調(diào)控規(guī)律。
總之,該研究揭示了MUC1通過增強PP2A活性,降低PKCζ磷酸化水平,繼而下調(diào)NUMB磷酸化,從而喚醒CSLCs轉(zhuǎn)向?qū)ΨQ分裂模式,最終導(dǎo)致CSLCs擴增的新機制;為MUC1陽性的SCLC治療提供了新的思路和策略。
該項研究是黃雷課題組在腫瘤干細胞調(diào)控及靶向治療方面又一重要發(fā)現(xiàn),該課題組之前的研究發(fā)表于Oncogenesis (2019),Signal Transduction and Targeted Therapy(2021),Oncogene(2022)及Cell Death & Disease(2022)。
上海交通大學醫(yī)學院李昇澤博士,復(fù)旦大學附屬兒科醫(yī)院董欣然博士,上海交通大學醫(yī)學院高珂星碩士,上海交通大學醫(yī)學院附屬胸科醫(yī)院王奕洋博士和中南大學附屬湘雅醫(yī)院李敏教授為該論文的共同第一作者,上海交通大學醫(yī)學院黃雷教授以及中南大學附屬湘雅醫(yī)院胡成平教授為該論文的共同通訊作者。本研究得到了國家自然科學基金面上項目和上海市市科委等多項資金的資助,并得到交大醫(yī)學院陳國強教授、金穎教授、黃鶯教授、王瓊教授及天津醫(yī)科大學劉喆教授的大力支持和幫助。