上海交通大學(xué)醫(yī)學(xué)院附屬第九人民醫(yī)院精準(zhǔn)醫(yī)學(xué)研究院雷鳴團(tuán)隊(duì)日前在核酶研究領(lǐng)域獲重大突破,揭示了真核生物中轉(zhuǎn)運(yùn)RNA(tRNA)前體5’端的加工成熟機(jī)制,或?qū)樾滦涂股卦O(shè)計(jì)提供重要依據(jù)。9月28日,這項(xiàng)最新研究成果以長(zhǎng)文的形式在線發(fā)表于國(guó)際權(quán)威學(xué)術(shù)期刊《科學(xué)》。
tRNA作為體內(nèi)重要的一類(lèi)RNA分子,主要起轉(zhuǎn)運(yùn)氨基酸的作用,它能夠攜帶氨基酸進(jìn)入核糖體,參與蛋白質(zhì)的生物合成。tRNA首先是以前體的形式被轉(zhuǎn)錄出來(lái),具有未成熟的5’和3’末端,其中5’端的成熟需要在進(jìn)化上十分保守的核糖核酸酶P(RNase
P)來(lái)催化完成。RNase
P存在于地球上的所有物種中,是生命活動(dòng)所必需的,是由RNA介導(dǎo)并負(fù)責(zé)tRNA前體催化反應(yīng)的核酶。真核生物的RNase P
是由一條長(zhǎng)鏈RNA分子(~300nt)和近十個(gè)蛋白質(zhì)亞基組成的分子機(jī)器。目前人們對(duì)于真核生物中RNase
P的組裝形式以及其底物識(shí)別和催化機(jī)制還了解甚少。
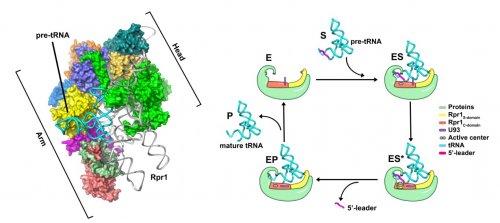
為此,雷鳴團(tuán)隊(duì)成功解析了酵母內(nèi)源RNase P 全酶及其與底物pre-tRNA的復(fù)合物結(jié)構(gòu),這個(gè)結(jié)構(gòu)揭示了真核生物中RNase
P各亞基在空間上原子分辨率的組織形式,各蛋白質(zhì)亞基緊密交織在一起形成鉤狀結(jié)構(gòu)來(lái)穩(wěn)定住RNA催化亞基的構(gòu)象。同時(shí)研究人員發(fā)現(xiàn)RNase
P以一種“雙錨定(double
anchor)”的機(jī)制來(lái)識(shí)別tRNA前體。tRNA的5’端被特異的錨定在催化中心,以促使其完成切割反應(yīng)。底物tRNA的結(jié)合誘導(dǎo)了該酶催化中心一個(gè)關(guān)鍵殘基的巨大的構(gòu)象變化。
結(jié)合分子動(dòng)力學(xué)模擬,研究團(tuán)隊(duì)提出了RNase P
催化反應(yīng)的雙鎂離子模型,深入闡釋了這一類(lèi)古老核酶的催化分子機(jī)制。這一里程碑式的研究工作首次完整的提出了真核生物RNase
P催化底物tRNA前體切割成熟的分子機(jī)制,為核酶及RNA結(jié)構(gòu)生物學(xué)領(lǐng)域的重大突破。特別是目前抗生素耐藥性已成為威脅人類(lèi)健康的一大隱患,
RNase P與核糖體作為唯一兩類(lèi)天然存在于所有物種中保守的核酶,是抗生素類(lèi)藥物重要的靶點(diǎn)。因此,RNase
P作為新型抗生素的潛在靶點(diǎn),對(duì)這一類(lèi)古老核酶的結(jié)構(gòu)研究將為后續(xù)的新型抗生素設(shè)計(jì)提供重要的分子基礎(chǔ)。
據(jù)悉,九院精準(zhǔn)醫(yī)學(xué)研究院蘭鵬飛助理研究員、雷鳴課題組譚明博士以及中科院大連化物所副研究員張躍斌為該論文的共同第一作者;九院精準(zhǔn)醫(yī)學(xué)研究院雷鳴研究員、武健研究員以及中科院大連化物所李國(guó)輝研究員為該論文的共同通訊作者;上海交通大學(xué)醫(yī)學(xué)院附屬第九人民醫(yī)院是第一單位;該研究受到國(guó)家自然科學(xué)基金項(xiàng)目以及中科院戰(zhàn)略性先導(dǎo)項(xiàng)目(B類(lèi))資助。
全文鏈接:http://science.sciencemag.org/content/early/2018/09/26/science.aat6678?rss=1

