近日,上海交通大學(xué)醫(yī)學(xué)院藥理學(xué)與化學(xué)生物學(xué)系高小玲研究員課題組在《美國(guó)化學(xué)學(xué)會(huì)-納米》(ACS Nano)雜志上,在線發(fā)表了題為“Tailored Reconstituted Lipoprotein for Site-Specific and Mitochondria-Targeted Cyclosporine A Delivery to Treat Traumatic Brain Injury”的研究論文。研究人員基于顱腦損傷病灶高表達(dá)基質(zhì)金屬蛋白酶-9(MMP-9),采用酶敏感細(xì)胞穿膜肽修飾的脂蛋白納米載體將多肽藥物環(huán)孢素A(cyclosporine A,CsA)高效遞送至病灶細(xì)胞的線粒體,從而減輕線粒體損傷緩解病情,極大提高了CsA用于顱腦損傷治療的安全性和有效性。
顱腦損傷作為一種常見(jiàn)的外傷而受到全世界醫(yī)療的廣泛關(guān)注,平均每年有將近5000萬(wàn)的新發(fā)患者。顱腦損傷是青壯年人口死亡的首要原因,也是全世界各年齡層人群的主要致死、致殘因素。針對(duì)顱腦損傷病程中關(guān)鍵病理改變——細(xì)胞線粒體損傷的治療策略是顱腦損傷疾病新藥研發(fā)的重要方向。
多肽藥物CsA的線粒體保護(hù)作用確切,然而由于其水溶性差,與血漿蛋白的結(jié)合率高,難以通過(guò)血腦屏障,需要給予高劑量才起到神經(jīng)保護(hù)作用。而在高劑量和長(zhǎng)期給藥的情況下,全身CsA水平高會(huì)產(chǎn)生限制性的不良反應(yīng),如免疫抑制、肝毒性和腎毒性等,嚴(yán)重限制了其臨床應(yīng)用。
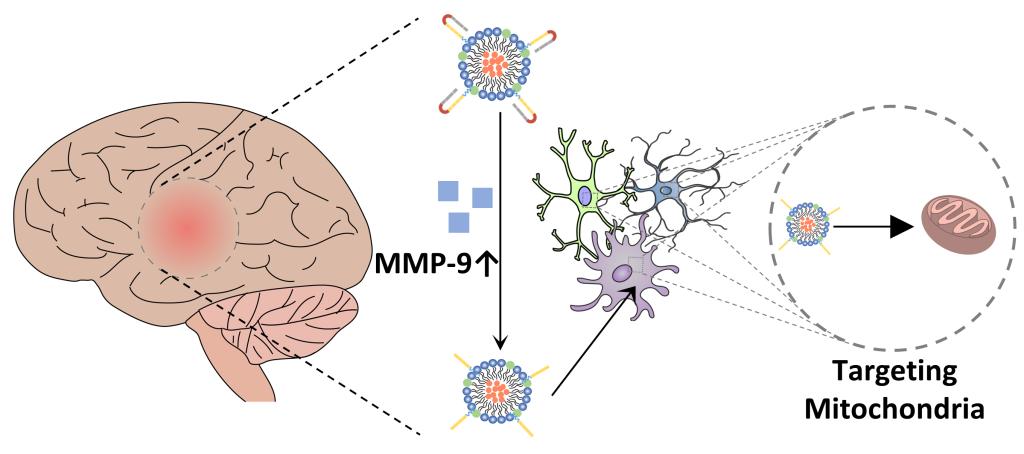
通過(guò)制劑學(xué)手段,該研究設(shè)計(jì)合成了MMP-9酶敏感的細(xì)胞穿膜肽,并通過(guò)自組裝方法將CsA包載于MMP-9酶敏感細(xì)胞穿膜肽修飾的脂蛋白納米載體中,不但解決了CsA體內(nèi)給藥的溶解度問(wèn)題,而且極大提高了CsA在顱腦損傷病灶的富集和對(duì)靶細(xì)胞線粒體的遞送,提升療效,降低不良反應(yīng),實(shí)現(xiàn)了CsA對(duì)顱腦損傷的高效、安全的治療。
上海交通大學(xué)醫(yī)學(xué)院基礎(chǔ)醫(yī)學(xué)院碩士研究生陳樂(lè)培以及實(shí)驗(yàn)師宋清香為該論文的共同第一作者,高小玲研究員和江淦講師為論文共同通訊作者。附屬仁濟(jì)醫(yī)院神經(jīng)外科江基堯教授和上海中醫(yī)藥大學(xué)陳紅專教授等給予重要合作支持。該研究得到了國(guó)家自然科學(xué)基金委、國(guó)家科技重大專項(xiàng)、上海市科委等項(xiàng)目資助。
原文鏈接:https://pubs.acs.org/doi/10.1021/acsnano.9b09186

