國際權(quán)威學(xué)術(shù)期刊《細(xì)胞》于北京時(shí)間10月26日在線發(fā)表了附屬九院精準(zhǔn)醫(yī)學(xué)研究院雷鳴課題組的最新研究成果Cryo-EM
structure of the human Ribonuclease P holoenzyme,揭示了人源關(guān)鍵核酶RNase
P催化tRNA前體加工成熟的分子機(jī)制。這是第一個(gè)高分辨率的人源RNase P
結(jié)構(gòu),也是繼雷鳴團(tuán)隊(duì)9月在《科學(xué)》雜志揭示了酵母RNase P的工作機(jī)理后,在高等生物中闡釋核酶RNase
P的組裝和工作原理的又一力作。
轉(zhuǎn)運(yùn)RNA(tRNA)作為生命體中遺傳信息的傳遞者,首先是以前體RNA的形式被轉(zhuǎn)錄出來,轉(zhuǎn)錄生成的tRNA前體具有未成熟的5’和3’末端,需要經(jīng)歷一系列的加工反應(yīng)才能完成最終的成熟。其中5’前導(dǎo)序列的切割是由一類必需的核酶RNase
P完成。人源RNase P
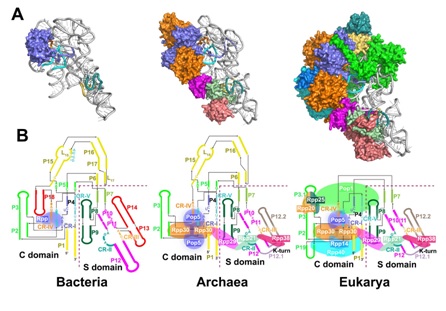
是由一條長鏈非編碼RNA和十個(gè)蛋白質(zhì)亞基組成的核糖核酸蛋白質(zhì)復(fù)合物,是人體內(nèi)最重要的核酶之一。解析RNase
P的高分辨率結(jié)構(gòu)對(duì)于理解這類核酶加工tRNA的機(jī)理以及這一古老核酶的進(jìn)化過程都至關(guān)重要。自上世紀(jì)80年代發(fā)現(xiàn)RNase P
并提出核酶這一概念以來,對(duì)于真核生物RNase P
的組裝和工作機(jī)理一直所知甚少。附屬九院附屬第九人民醫(yī)院雷鳴團(tuán)隊(duì)在世界上率先解析了真核生物RNase
P結(jié)合底物pre-tRNA的近原子分辨率結(jié)構(gòu),極大的推動(dòng)了核酶及RNA結(jié)構(gòu)生物學(xué)這一領(lǐng)域的發(fā)展。
在最新發(fā)表的論文中,雷鳴團(tuán)隊(duì)成功從人的細(xì)胞中提取出RNase P復(fù)合物并利用冷凍電鏡單顆粒重構(gòu)技術(shù)解析了人源RNase
P全酶及其與底物復(fù)合物的近原子分辨率結(jié)構(gòu)。該結(jié)構(gòu)揭示了人源RNase P 同樣通過“雙錨定”(double
anchor)的機(jī)制來識(shí)別tRNA底物,tRNA的結(jié)合誘導(dǎo)了酶催化中心一個(gè)巨大的構(gòu)象變化,使該酶從失活轉(zhuǎn)化到活性狀態(tài)。更為重要的是,該文章首次提出了RNase
P 這一古老核酶的進(jìn)化模型,揭示了細(xì)菌RNase P
RNA亞基中的輔助RNA元件逐步退化,進(jìn)化到高等生物中由更加復(fù)雜的蛋白質(zhì)組分所替代。
附屬九院精準(zhǔn)醫(yī)學(xué)研究院武健研究員,雷鳴課題組牛雙雙碩士及譚明博士為文章的共同第一作者;精準(zhǔn)醫(yī)學(xué)研究院雷鳴研究員與蘭鵬飛助理研究員為該論文的通訊作者。上海交通大學(xué)醫(yī)學(xué)院附屬第九人民醫(yī)院是第一單位;該研究受到國家自然科學(xué)基金項(xiàng)目以及中科院戰(zhàn)略性先導(dǎo)項(xiàng)目(B類)資助。
原文鏈接:https://doi.org/10.1016/j.cell.2018.10.003

