
化療與光療(光動(dòng)力治療PDT或光熱治療)聯(lián)合治療(chemophototherapy)在實(shí)體腫瘤治療中顯示出很好的應(yīng)用前景。鉑納米粒(nano-Pt)作為一種擬過氧化氫酶(CAT)的納米酶(nanozyme),可通過催化腫瘤部位的過氧化氫(H2O2)供氧(O2),克服PDT療效受到的腫瘤缺氧微環(huán)境的制約。鉑納米粒還可通過浸出鉑離子作為化學(xué)治療劑殺傷腫瘤細(xì)胞。然而,現(xiàn)今研究報(bào)道一直關(guān)注鉑納米粒的CAT或化療活性,如何在實(shí)體腫瘤PDT中發(fā)揮其協(xié)同效應(yīng)亟待探索。
典型的鉑納米粒的遞送方法是將它們通過原位生長的方式附著在其他治療用納米載體上,由于這些載體尺寸較大(90-130 nm),滲透進(jìn)入腫瘤深部的作用較弱,鉑納米粒對(duì)深部腫瘤細(xì)胞的化療毒性作用受到限制。因此,如何既使小粒徑鉑納米粒保持自由狀態(tài)(不受現(xiàn)有原位生長方法的限制),實(shí)現(xiàn)對(duì)腫瘤組織的有效滲透,同時(shí)又對(duì)它們進(jìn)行高效地裝載和遞送是面臨的主要挑戰(zhàn)。
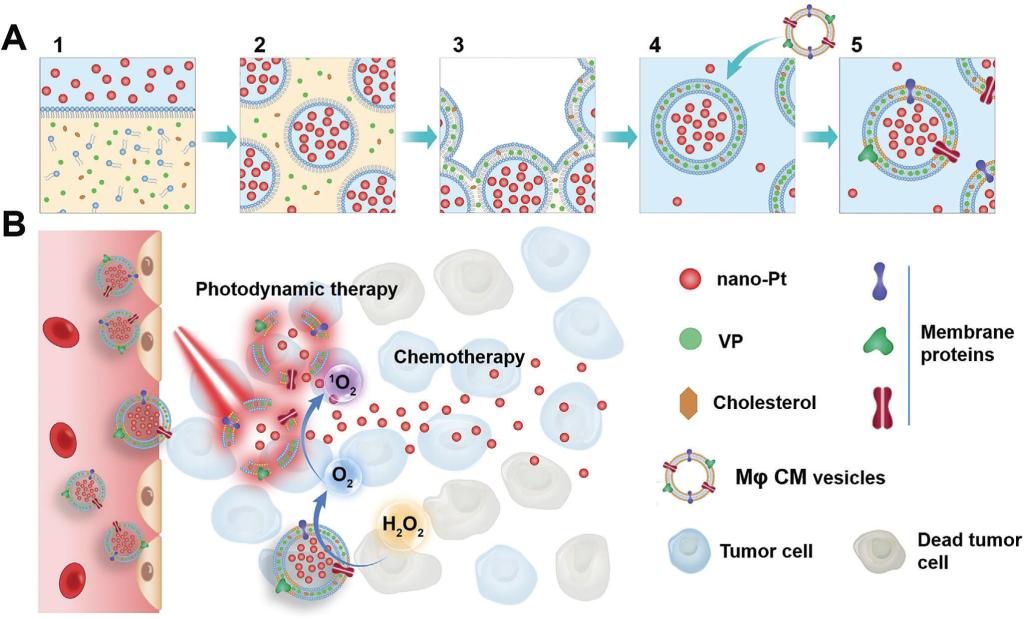
近日,上海交通大學(xué)醫(yī)學(xué)院方超教授團(tuán)隊(duì)等在Advanced Science期刊上以封面(Cover Picture)形式發(fā)表題為“Biomimetic Liposomal Nanoplatinum for Targeted Cancer Chemophototherapy”的論文。研究人員通過逆相蒸發(fā)(reverse phase evaporation)技術(shù)成功地將親水性、超小尺寸的鉑納米粒(3-5 nm)包封在脂質(zhì)體內(nèi)水腔中(包封率46%),脂質(zhì)雙層荷載疏水性臨床批準(zhǔn)的光敏劑維替泊芬(VP),進(jìn)一步與巨噬細(xì)胞的細(xì)胞膜雜交,得到具有長循環(huán)和炎性內(nèi)皮(例如腫瘤血管)靶向的仿生鉑納米粒脂質(zhì)體。
在腫瘤部位,鉑納米粒催化產(chǎn)生的氧氣(O2)可增強(qiáng)VP介導(dǎo)的PDT。反過來,PDT通過增強(qiáng)脂質(zhì)體膜的通透性,觸發(fā)鉑納米粒“超快速”釋放(光照5 min,釋放> 95%)。超小的鉑納米粒進(jìn)而可滲透進(jìn)入腫瘤組織。有趣的是,催化產(chǎn)生的O2也會(huì)增強(qiáng)鉑納米粒的運(yùn)動(dòng)性和腫瘤滲透作用,增強(qiáng)化療作用。小鼠實(shí)驗(yàn)中,單次注射仿生鉑納米粒脂質(zhì)體結(jié)合光照可高效抑制侵襲性4T1乳腺腫瘤的生長(抑制率90%)及其肺轉(zhuǎn)移(抑制率100%),延長動(dòng)物存活時(shí)間(中位生存期延長72%)。劑量爬升實(shí)驗(yàn)和安全性評(píng)價(jià)研究顯示,鉑納米粒脂質(zhì)體治療方案耐受性好,沒有明顯的毒副作用。該研究工作為腫瘤多模式聯(lián)合治療和抗腫瘤藥物高效共遞送系統(tǒng)的設(shè)計(jì)提供了新思路。
上海交通大學(xué)基礎(chǔ)醫(yī)學(xué)院博士研究生劉學(xué)良為論文的第一作者,上海交通大學(xué)醫(yī)學(xué)院方超教授和上海中醫(yī)藥大學(xué)陳紅專教授為該論文的通訊作者。美國University at Buffalo(SUNY)Jonathan F. Lovell教授和加拿大多倫多大學(xué)鄭崗(Gang Zheng)教授給予了重要支持和幫助。該研究得到國家自然科學(xué)基金和上海市科委項(xiàng)目的資助。

