
近日,范先群教授團隊在開發(fā)腫瘤納米診療試劑的研究中取得重要進展。該研究首次發(fā)現(xiàn)納米材料可提高葡萄膜黑色素瘤(Uvealmelanoma,UM)細胞內的活性氧自由基(Reactive Oxygen Species,ROS)水平,不同濃度納米材料介導的ROS對UM細胞的惡性生長能力影響不同,一定量的ROS可激活UM細胞mTOR信號通路,增強氨基酸代謝。該研究對于納米材料腫瘤診斷和治療應用中安全濃度的合理選擇具有十分重要的參考價值。研究結果以“Dose Dependent Carbon Dot Induced ROS Promote Uveal Melanoma Cell Tumorigenicity via Activation of mTOR Signaling and Glutamine Metabolism”為題于2021年4月22日正式發(fā)表于國際頂級學術期刊《Advanced Science》。
ROS主要為細胞代謝所產生的副產物(例如超氧陰離子、H2O2、羥自由基、羥離子等)。當細胞內的ROS與抗氧化物(例如抗壞血酸、谷胱甘肽等)之間的平衡被打破時,便會產生氧化應激反應,過氧化細胞內生物大分子,從而損傷細胞。由于腫瘤細胞代謝旺盛,因此ROS在諸多類型的腫瘤中顯著上升。為此,大量研究利用納米材料調控腫瘤細胞內產生過量的ROS殺傷腫瘤。然而,ROS亦可作為誘導或信號分子在腫瘤形成、惡性轉化、化療耐藥中發(fā)揮重要作用。納米材料誘導產生的ROS是否會對腫瘤發(fā)生發(fā)展產生未知影響,這一關鍵問題對于應用納米材料診療腫瘤具有重要的作用,因此亟待明確。
UM是成人最常見的眼內惡性腫瘤,惡性程度高,易轉移,預后差,嚴重威脅患者視力和生命安全。葡萄膜黑色素瘤起源于脈絡膜、睫狀體或虹膜的黑色素細胞。由于紫外線的暴露及黑色素的生成,相較于其他正常細胞,黑色素細胞更易受ROS的調控影響而增加黑色素瘤的發(fā)生風險。若利用納米材料介導的ROS技術早期檢測或協(xié)同治療UM,就存在加強腫瘤發(fā)生發(fā)展的風險。因此,該團隊利用不同濃度的碳點納米材料誘導UM細胞產生不同水平的ROS,全面分析其是否能起到信號分子的作用,對腫瘤細胞發(fā)生發(fā)展產生不同作用,并基于腫瘤代謝角度闡述了這一現(xiàn)象背后的機制。
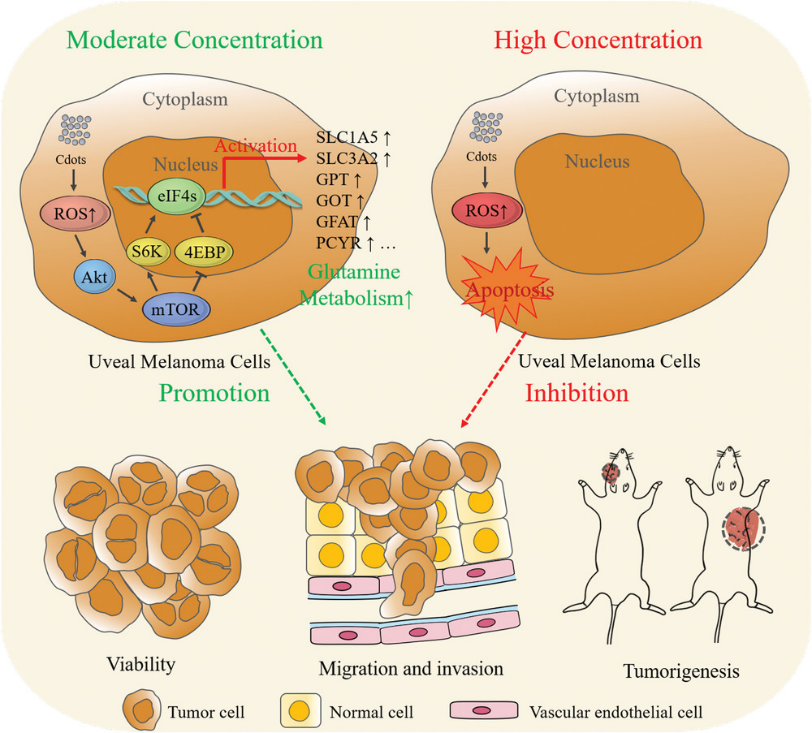
研究團隊首先結合ROS熒光顯示技術及細胞內氧化還原狀態(tài)檢測技術分析了UM細胞在接受碳點(C-dots)短期刺激后胞內ROS水平、抗氧化能力和細胞表型變化,結果表明不同濃度C-dots處理的UM細胞抗氧化能力皆然不同,低劑量(25-100 μg/mL)的C-dots可增強UM細胞內ROS水平,同時細胞抗氧化能力增強,氧化還原水平得到再平衡,UM細胞增殖、遷移、侵襲、體外成瘤能力增強,在加入抗氧化劑NAC或Toc以消除ROS的影響后,C-dots的促進作用消失,而高劑量(200 μg/mL)C-dots產生的ROS由于打破細胞的氧化還原平衡,過氧化生物大分子,導致UM細胞凋亡,該結果在斑馬魚移植瘤模型及眼內原位荷瘤小鼠模型都得到相同驗證結果。為了探索這一現(xiàn)象背后的機制,研究團隊應用非靶向代謝組學技術(LC-MS)聯(lián)合谷氨酰胺代謝相關基因mRNA表達圖譜發(fā)現(xiàn)C-dots誘導的ROS通過激活Akt/mTOR通路,促進谷氨酰胺代謝,加速谷氨酰胺水解成谷氨酸,為谷胱甘肽的合成提供原料,從而調控細胞氧化還原平衡。同時,谷氨酸可進一步經轉氨酶作用生成α-酮戊二酸,進入三羧酸循環(huán)生成更多ATP,從而促進腫瘤細胞生長。
第九人民醫(yī)院眼科丁伊博士和俞杰博士為該論文共同第一作者,范先群教授、KamW.Leong教授、阮靜研究員為共同通訊作者。論文獲國家重點研發(fā)計劃、國家自然科學基金委、國家留學基金委、上海市科學技術委員會等資助。
文章鏈接:
https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202002404

