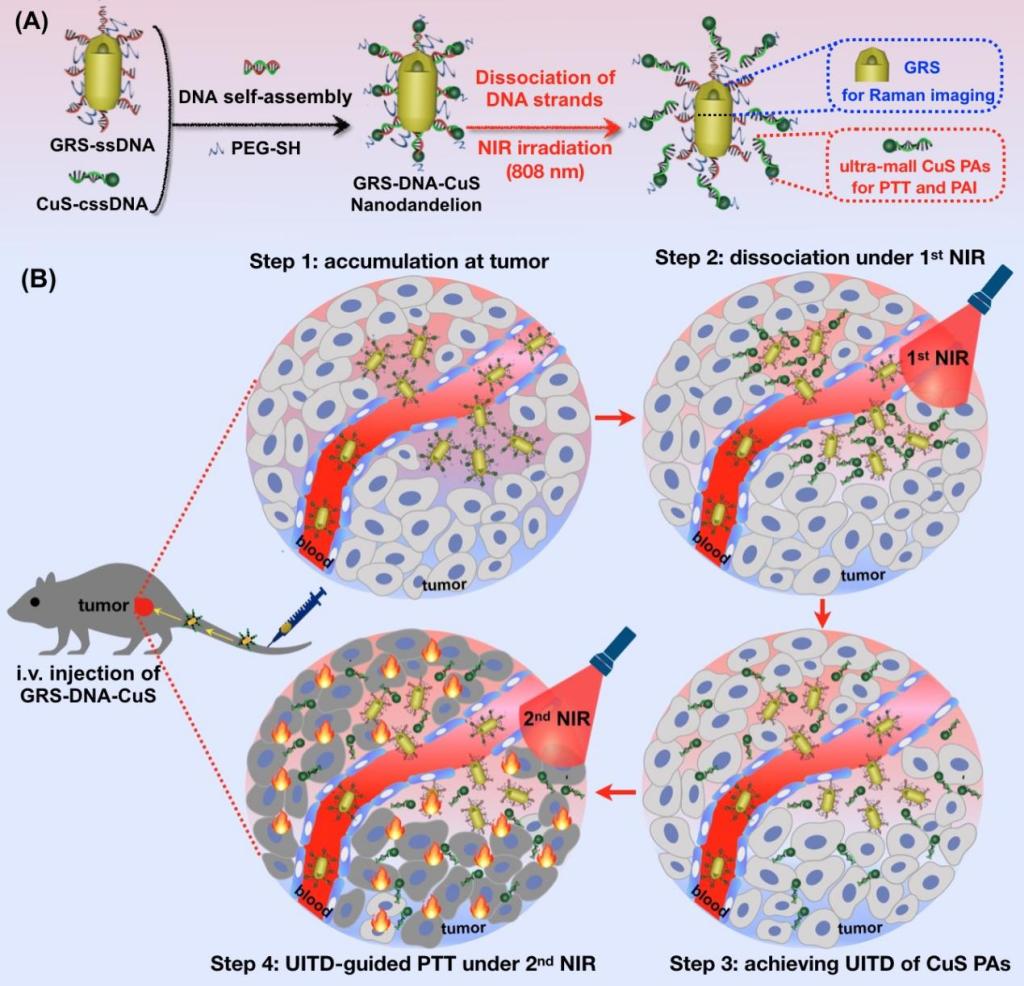
近日,基礎醫(yī)學院肖澤宇教授課題組在生物材料領域知名期刊Biomaterials上發(fā)表了題為“DNA-assembled visible nanodandelions with explosive hydrogen-bond breakage achieving uniform intra-tumor distribution (UITD)-guided photothermal therapy”的研究成果。該研究基于DNA自組裝技術構建了一種類似蒲公英結構的可視化納米藥物,命名為DNA自組裝納米蒲公英。此納米蒲公英利用DNA雙鏈中氫鍵的爆破式熱解離特性,使光熱試劑在腫瘤內(nèi)由大粒徑解離為小粒徑,并可視化地監(jiān)控其在腫瘤組織內(nèi)時空均勻分散的過程,顯著提高了光熱治療的療效。

腫瘤光熱療法是將光熱試劑聚集在腫瘤組織,并利用近紅外光(NIR)照射觸發(fā),將光能轉化為熱能來殺死癌細胞的一種治療方法。由于具有較深的組織穿透性、較高的空間選擇性和較低的系統(tǒng)毒性等優(yōu)勢,已成為最具臨床應用前景的局部熱消融腫瘤的方法。然而,光熱療法的瓶頸在于,光熱試劑難以在腫瘤內(nèi)均勻分布,以致只有光熱試劑富集處的癌細胞會被較高的光熱溫度殺傷,而沒有光熱試劑富集的癌細胞由于局部溫度較低仍然存活,導致療效受限。
針對這一重要醫(yī)學問題,研究者受到風吹蒲公英后種子散落的啟發(fā),制備了一種類蒲公英結構的DNA自組裝可視化納米藥物,命名為DNA自組裝納米蒲公英(GRS-DNA-CuS)。此納米蒲公英是由DNA雙鏈(如同蒲公英的花柱)將內(nèi)核拉曼影像探針GRS(如同蒲公英的花托)和外殼超小CuS光熱試劑(如同蒲公英的種子)自組裝于一體。由于納米蒲公英GRS-DNA-CuS具有較高的光熱轉化效應,在第一次NIR輻照后,能夠迅速達到DNA的解鏈溫度,導致氫鍵爆破式斷裂,使得富集到腫瘤處的大粒徑納米蒲公英GRS-DNA-CuS(~135 nm)完全、徹底地解離成兩部分:GRS和超小CuS光熱試劑(~12nm)。由于腫瘤局部超小CuS光熱試劑的濃度迅速增加,促使其在腫瘤組織內(nèi)具有較強的擴散能力,6小時即可在腫瘤內(nèi)均勻擴散開,猶如風吹打蒲公英后種子四處飄散。隨后,已經(jīng)完成瘤內(nèi)均勻分布的超小CuS光熱試劑,在第二次NIR輻照下,達到光熱消融所有癌細胞,高效根除腫瘤的目標。與此同時,具有較好空間分辨率的拉曼成像和較強組織穿透性的光聲成像技術,為兩次近紅外光輻照提供了精準的光照時間和空間位置,以可視化的方式監(jiān)控了光熱試劑在腫瘤處富集、解離、擴散和光熱治療的整個過程,顯著提升了光熱治療的療效。總之,我們提出可視化監(jiān)控光熱試劑在瘤內(nèi)均勻分散的理念,為光熱高效治療腫瘤提供了新的研究思路。
上海交通大學基礎醫(yī)學院博士生張永明,助理研究員崔彥娜和碩士生李明旺為該論文的共同第一作者。肖澤宇教授為該論文的通訊作者。該研究獲得國家重點研發(fā)計劃、國家自然科學基金國際(地區(qū))合作項目等資助。

