
5月23日,上海交通大學基礎醫(yī)學院生化與分子細胞生物學系童雪梅教授課題組、上海市免疫學研究所李斌研究員課題組和復旦大學附屬華山醫(yī)院/腦科學與轉化研究院楊輝研究員等合作在Nature Metabolism雜志在線發(fā)表題為Non-oxidative pentose phosphate pathway controls regulatory T cell function by integrating metabolism and epigenetics的研究論文,揭示非氧化磷酸戊糖途徑(非氧化PPP)調控調節(jié)性T細胞(Treg)功能的新作用及其機制。倫敦帝國理工學院Margarita Dominguez-Villar博士在同期Nature Metabolism雜志為該研究撰寫News & Views特評,認為該文章發(fā)現(xiàn)非氧化PPP在Treg活化和功能調控中的中心地位(a central regulator)。

表達特征轉錄因子Foxp3的Treg是一類具有免疫抑制功能的CD4+T細胞亞群,維持機體免疫系統(tǒng)穩(wěn)態(tài),防止免疫過激誘發(fā)自身免疫病。非氧化PPP包括4個代謝酶催化的5步可逆反應,可以通過改變代謝物流向來滿足細胞的功能需求。非氧化PPP是否參與Treg功能調控尚不清楚。
轉酮醇酶TKT是非氧化PPP中催化兩步可逆反應的代謝酶。童雪梅團隊已發(fā)現(xiàn)TKT在肝臟、脂肪和腸道中調控糖脂代謝平衡的重要作用(Li M et al, Cancer Research, 2019; Tian N et al, Diabetes, 2020; Tian N et al, Cell Death & Disease, 2021)。在本研究中,Treg特異性敲除TKT的小鼠出生3周后發(fā)生嚴重自身免疫性疾病,并且在斷奶之后相繼死亡,其表型與缺失Foxp3基因的小鼠相似。進一步研究發(fā)現(xiàn),敲除TKT在不改變Treg數(shù)目和轉錄因子Foxp3水平的情況下,抑制Treg的免疫抑制功能。其機制是,TKT缺失導致Treg的NADPH減少和氧化應激增加,葡萄糖進入線粒體氧化減少,脂肪酸氧化增加,氨基酸分解代謝顯著增強,分解代謝重構使線粒體功能受損。同時,被氧化應激和線粒體損傷誘發(fā)的還原性TCA循環(huán)使α-酮戊二酸/琥珀酸及α-酮戊二酸/富馬酸比率降低,DNA甲基化增加,抑制Treg特征性功能基因表達,導致其免疫抑制性功能喪失。
文章發(fā)現(xiàn)非氧化PPP中的轉醛醇酶(TAL)對維持效應性Treg特征性功能基因表達也不可或缺。此外,在自身免疫性病人外周血Treg細胞中,TKT水平顯著降低。
此研究首次揭示非氧化PPP整合三大營養(yǎng)物質代謝和表觀遺傳修飾從而控制Treg功能,將為通過調控Treg功能防治自身免疫性疾病和其他免疫相關疾病提供新思路。
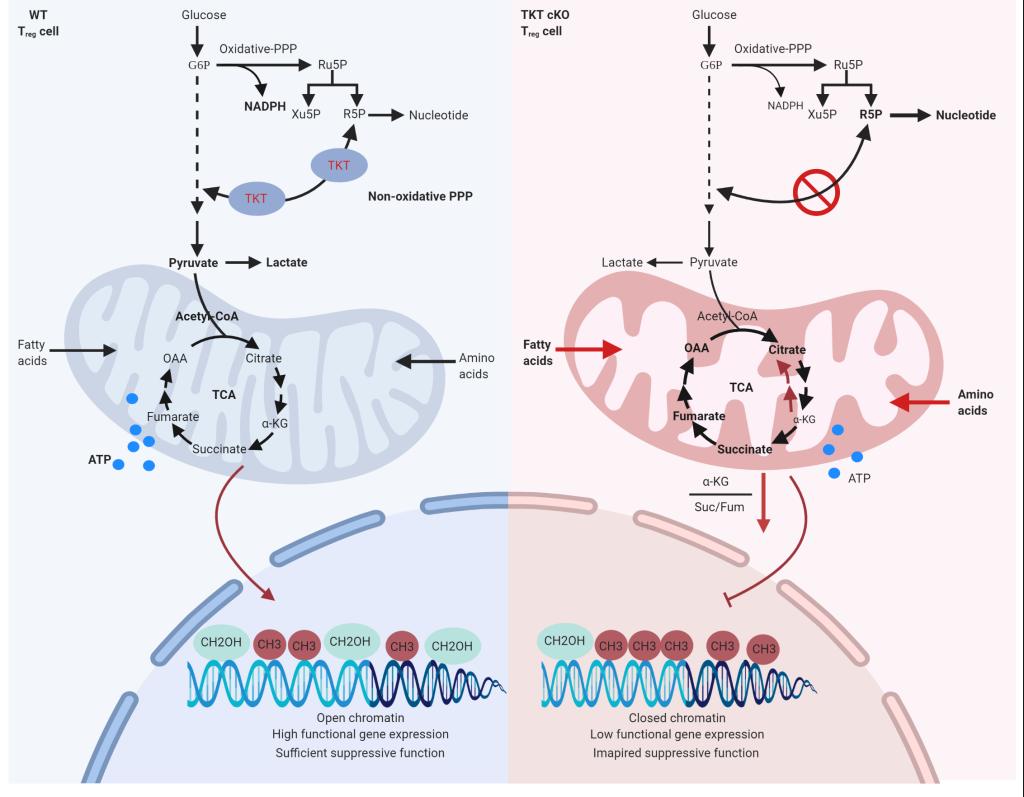
非氧化PPP通過整合代謝組和表觀遺傳組調控Treg功能
上海交通大學醫(yī)學院博士生劉琪、阿拉巴馬大學伯明翰分校博士生朱方明和上海市免疫學研究所博士生劉鑫男是該研究論文的共同第一作者。此項研究得到復旦大學醫(yī)學院葉丹研究員、海軍軍醫(yī)大學附屬長征醫(yī)院風濕免疫科徐滬濟主任、上海交通大學附屬仁濟醫(yī)院沈南主任、上海交通大學基礎醫(yī)學院徐天樂教授、清華大學藥學院胡澤平研究員、阿拉巴馬大學伯明翰分校胡暉教授等合作實驗室的大力協(xié)助。通訊作者為童雪梅教授、李斌研究員和楊輝研究員。該研究獲國家重點研發(fā)計劃、國家自然科學基金委和上海市科學技術委員會科學基金委等資助。

