10月4日,上海交通大學醫(yī)學院藥理學與化學生物學系沈瑛課題組在腫瘤學研究領域經(jīng)典期刊Cancer Research發(fā)表封面文章“Metabolic and non-metabolic functions of PSAT1 coordinate signaling cascades to confer EGFR-inhibitor resistance and drive progression in lung adenocarcinoma”,揭示PSAT1兼具代謝酶活性及非代謝調(diào)控的蛋白互作功能,協(xié)同調(diào)控ROS/JNK/c-Jun和IQGAP1-STAT3信號軸,共同促進肺腺癌耐藥和轉(zhuǎn)移的創(chuàng)新機制。

如封面所示:磷酸絲氨酸氨基轉(zhuǎn)移酶1(PSAT1)就像高速運轉(zhuǎn)的機械轉(zhuǎn)盤,上方裝載靈活精巧的機械手臂(代謝酶活性)調(diào)控細胞內(nèi)氧化還原平衡(紅、藍氣泡),下方裝載伸縮自如的橢圓吸盤(蛋白互作功能),募集并激活IQGAP1-STAT3信號軸(紫-粉蛋白卡通),共同促進肺腺癌對Erlotinib耐藥和轉(zhuǎn)移。近期Cancer Research雜志中已發(fā)表多篇研究論文和綜述探討代謝重編程及其關鍵酶在腫瘤惡性進展和臨床預后之間的關系,沈瑛團隊文章榮幸被選為當期封面刊登,充分體現(xiàn)出該論文的重要發(fā)現(xiàn)和潛在引領作用,也生動展現(xiàn)了研究成果蘊含的科學理念和創(chuàng)新之處。

Cancer Research當期封面文章(2022 Oct 1;82(19):3516–31)
PSAT1兼具代謝酶活性及非代謝調(diào)控的蛋白互作功能
上海交通大學醫(yī)學院沈瑛研究員為該論文通訊作者。上海交通大學醫(yī)學院2021級博士研究生羅鳴宇、畢業(yè)碩士生周燁和顧瑋銘為論文共同第一作者。該工作得到了上海中醫(yī)藥大學交叉科學研究院陳紅專教授、上海交通大學醫(yī)學院朱亮教授、上海交通大學醫(yī)學院附屬仁濟醫(yī)院莊光磊研究員、上海中醫(yī)藥大學附屬岳陽醫(yī)院許玲教授等多位專家指導和支持,以及教育部共建上海市生物醫(yī)藥臨床研究與轉(zhuǎn)化協(xié)同創(chuàng)新中心、細胞分化與凋亡教育部重點實驗室、細胞穩(wěn)態(tài)調(diào)控疾病前沿科學中心、上海交通大學基礎醫(yī)學院公共技術平臺提供大力支撐;項目獲得國家自然科學基金和上海市科委項目等資助。
專家點評

傅海安教授 美國埃默里(Emory)大學
每當我們慶祝新一代抗癌藥物的成功,腫瘤就已經(jīng)筑起了抗藥的壁壘,導致藥效的降低,甚至治療的失敗。所以揭示腫瘤內(nèi)rewired oncogenic programs和抗耐藥分子機理對我們發(fā)展新藥,臨床應用意義重大。近年來,越來越多研究闡明腫瘤代謝酶兼具代謝酶活性及非代謝調(diào)控的多重功能,在腫瘤惡性進展中發(fā)揮重要作用,已成為抗腫瘤藥物新靶標研究的前沿熱點。但是對于腫瘤代謝酶多重功能的相關研究尚未透徹。Erlotinib等表皮生長因子受體酪氨酸激酶(EGFR)抑制劑分子靶向藥物治療肺腺癌療效顯著,但極易耐藥、引起患者腫瘤復發(fā)及轉(zhuǎn)移,深入研究腫瘤耐藥和轉(zhuǎn)移的腫瘤代謝酶機制有助于改進腫瘤治療策略。
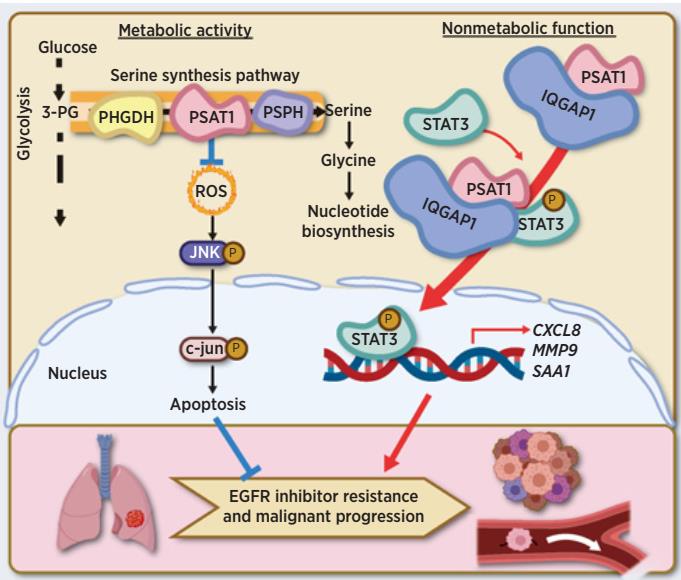
PSAT1是絲氨酸合成通路的關鍵酶之一,它催化3-磷酸羥基丙酮酸(3-PPyr)轉(zhuǎn)化成磷酸絲氨酸(p-serine),p-serine可進一步生成絲氨酸和甘氨酸,參與下游一碳代謝和核酸代謝;PSAT1同時催化細胞中谷氨酸生成α-酮戊二酸(α-KG)進入三羧酸循環(huán),參與復雜代謝網(wǎng)絡調(diào)控,為腫瘤細胞提供增殖所需物質(zhì)基礎及能量,并維持胞內(nèi)氧化還原平衡。
2022年10月4日,上海交通大學醫(yī)學院沈瑛研究員課題組在Cancer Research上以長文(Article)形式在線發(fā)表題為“Metabolic and non-metabolic functions of PSAT1 coordinate signaling cascades to confer EGFR-inhibitor resistance and drive progression in lung adenocarcinoma”的封面文章,報道了絲氨酸合成通路關鍵酶PSAT1兼具經(jīng)典的代謝酶活性及非代謝調(diào)控的蛋白互作功能,協(xié)同調(diào)控ROS/JNK/c-Jun和IQGAP1-STAT3信號軸,促進肺腺癌對EGFR抑制劑耐藥和轉(zhuǎn)移。
該研究發(fā)現(xiàn)在肺腺癌細胞經(jīng)Erlotinib短期適應性耐藥和長期獲得性耐藥過程中,葡萄糖來源從頭合成的絲氨酸及其合成通路關鍵酶PHGDH、PSAT1和PSPH蛋白水平均顯著增加。敲低PSAT1能優(yōu)先抑制耐藥細胞的增殖及運動,恢復耐藥細胞對Erlotinib的敏感性,增強Erlotinib對肺腺癌的殺傷作用。反之過表達PSAT1可促進肺腺癌Erlotinib耐藥和腫瘤轉(zhuǎn)移。機制研究表明PSAT1不僅通過絲氨酸合成通路調(diào)控肺腺癌細胞內(nèi)氧化還原穩(wěn)態(tài),還能不依賴于其經(jīng)典代謝酶活性,和IQGAP1蛋白相互作用,隨后募集并激活下游STAT3信號通路,從而促進肺腺癌EGFR-TKIs耐藥和轉(zhuǎn)移。臨床樣本數(shù)據(jù)庫分析結果證實PSAT1水平與肺腺癌患者的惡性進展和轉(zhuǎn)移顯著正相關,PSAT1-IQGAP1-STAT3信號軸與患者較差的預后密切相關。
該研究成果揭示了PSAT1促進肺腺癌EGFR-TKIs耐藥和轉(zhuǎn)移的新機制,為深入研究PSAT1與肺腺癌惡性進展之間的關系提供實驗理論基礎,為靶向PSAT1的抗腫瘤藥物定向設計提供新的思路。值得關注的是,以往研究報道發(fā)現(xiàn)腫瘤特異性蛋白-蛋白相互作用(OncoPPI)廣泛存在,為探索潛在的新型抗癌藥物靶點提供了豐富的資源和巨大的機遇。對新發(fā)現(xiàn)的促肺腺癌的PSAT1和PSAT1-IQGAP1 oncoPPI的進一步研究有望加速新一代抗癌藥物的研發(fā)。

