當前,藥物設計及研發(fā)的一個熱門方向是構(gòu)筑雙價配體分子。該類分子是將兩個藥效明確的配體分子通過連接子偶聯(lián)形成;其中,每個配體分子分別識別兩個不同蛋白受體的位點、或同一蛋白受體的不同位點(如正構(gòu)或變構(gòu)位點),并通過連接子協(xié)調(diào)配體-受體的相互作用,從而增強藥物療效、提高藥物選擇性、并克服耐藥等[1]。雙價配體分子可以調(diào)控的蛋白受體眾多,如G蛋白偶聯(lián)受體(GPCR)、激酶、離子通道、氧化酶以及二聚化蛋白等。由于在藥物研發(fā)上的優(yōu)勢,雙價配體分子越來越受到國際各大研究機構(gòu)的關注,對許多傳統(tǒng)意義上不可成藥的靶點賦予新的成藥潛力,且已有雙價配體分子進入臨床研究[2],展示了廣闊的開發(fā)前景。
構(gòu)筑雙價配體分子的關鍵是連接子的篩選及優(yōu)化,因為它能夠通過調(diào)節(jié)兩個配體分子的空間距離及空間構(gòu)象,影響藥理學活性。當前方法主要采用聚合物(如聚乙烯、聚乙二醇等)作為連接子來構(gòu)筑并篩選雙價配體分子,面臨以下問題:首先,聚合物連接子在合成中聚合度難以精確控制,導致難以精準調(diào)控藥效團之間的空間距離;其次,聚合物連接子常由單一重復單元構(gòu)成,難以實現(xiàn)配體分子與受體結(jié)合時空間取向的精細調(diào)節(jié);此外,構(gòu)筑篩選過程中需要將不同長度及結(jié)構(gòu)組成的聚合物連接子逐一與藥效團進行化學偶聯(lián),合成及純化步驟繁瑣。綜上,雙價配體分子的高效構(gòu)筑及精細調(diào)控是制約本領域發(fā)展的瓶頸問題。
近日,上海交通大學醫(yī)學院肖澤宇課題組與張健課題組合作,在Cell重要子刊Chem在線發(fā)表了題為DNA-modularized construction of bivalent ligands precisely regulates receptor binding and activation的研究論文,開發(fā)了DNA模塊化可編程的策略來構(gòu)筑雙價配體分子,實現(xiàn)在單脫氧核苷酸水平對受體識別及激活構(gòu)象的精細調(diào)控。該策略借鑒DNA分子的可編程構(gòu)筑方式,將兩個配體分子分別修飾成可用于DNA固相合成的“類核苷酸”藥效團模塊,將天然脫氧核苷酸作為連接子模塊,并利用DNA固相合成儀,自動化高效構(gòu)筑雙價配體分子的篩選庫。通過編程脫氧核苷酸的數(shù)目來精細調(diào)節(jié)連接子的長度,實現(xiàn)對兩個藥效團之間空間距離在0.33納米尺度的調(diào)控;通過編程脫氧核苷酸的堿基排列來調(diào)節(jié)連接子的結(jié)構(gòu)多樣化,實現(xiàn)對藥效團空間取向的精細調(diào)控,從而高效篩選獲得對受體識別親和力最高、激動效能最強的雙價配體分子。該策略為雙價配體分子的設計開發(fā)提供了全新的思路,在藥物設計及生物醫(yī)學研究領域具有廣泛的應用前景。

為證實此設計策略的可行性,團隊結(jié)合各自的研究優(yōu)勢,針對同一蛋白受體的正構(gòu)和變構(gòu)位點,構(gòu)筑了一個“正構(gòu)-變構(gòu)”雙價配體分子,即一個配體分子與蛋白受體的正構(gòu)位點結(jié)合,另一個配體分子與變構(gòu)位點結(jié)合。具體而言,本工作中蛋白受體選用M1毒蕈堿型乙酰膽堿受體(M1Rs),是一類與認知功能、腫瘤發(fā)生發(fā)展密切相關的GPCR受體。雙價配體分子中,一個配體分子為正構(gòu)激動劑占諾美林(簡稱X),識別M1Rs的正構(gòu)位點;另一個配體分子為變構(gòu)調(diào)節(jié)劑BQCA(簡稱B),識別M1Rs的變構(gòu)位點。通過這樣一個“正構(gòu)-變構(gòu)”雙價配體分子的協(xié)同調(diào)節(jié),實現(xiàn)對M1受體(而非M2~M5受體)亞型的識別及激動選擇性,降低副作用。
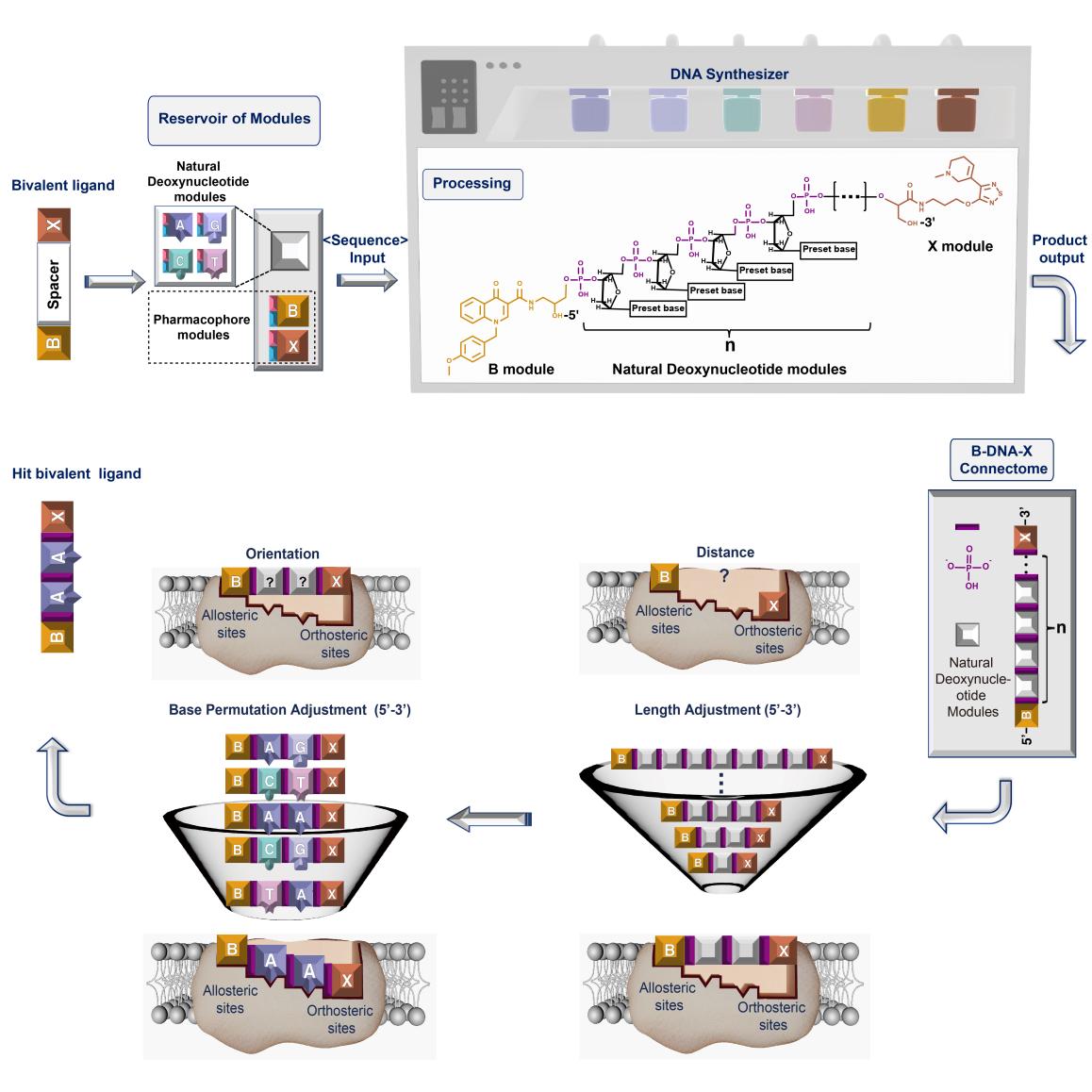
研究團隊首先借鑒天然脫氧核苷酸的修飾策略構(gòu)建了X與B的藥效團模塊,并證實修飾后保留了原藥的活性。進一步,利用DNA固相合成技術(shù),設計了藥效團間含有1-7個脫氧核苷酸的雙價配體,篩選發(fā)現(xiàn)當連接子為兩個脫氧核苷酸時,雙價配體對于M1受體的選擇性最強。在此基礎上,對兩個脫氧核苷酸的堿基排列進行編程,得到16種含有不同結(jié)構(gòu)組成連接子的雙價配體庫,篩選發(fā)現(xiàn)單脫氧核苷酸水平排列的差異化使雙價配體對M1受體激動的效價強度呈現(xiàn)出最低10-3的細微改變,且當連接子的堿基排列為“AA”時,雙價配體選擇性激動M1受體的能力最強,比傳統(tǒng)方法提高近30倍。
最后,研究團隊探討了此最優(yōu)雙價配體與M1受體作用的分子機制。通過分子對接預測并實驗證實了此雙價配體與M1受體作用的氨基酸位點。據(jù)此通過分子動力學模擬,發(fā)現(xiàn)BAAX雙價配體可將M1受體構(gòu)象穩(wěn)定在其激活構(gòu)象最接近的狀態(tài),從而展示了強效激活M1受體的能力。
上海交通大學醫(yī)學院肖澤宇教授與張健教授為該論文的通訊作者。上海交通大學醫(yī)學院趙娜博士、吳文偉博士、王穎碩士為該論文的第一作者。該工作受到上海交通大學醫(yī)學院分子醫(yī)學研究院譚蔚泓院士和教育部共建上海市生物醫(yī)藥臨床研究與轉(zhuǎn)化協(xié)同創(chuàng)新中心陳紅專教授等的指導和大力支持。
專家點評:
樊春海(中國科學院院士, DNA科學技術(shù)領域?qū)<遥?/strong>
DNA作為萬物生命起源的主要遺傳分子,無論是從生物學性質(zhì)、化學結(jié)構(gòu)、合成方式等,均為人類文明進步發(fā)展帶來了許多啟迪。例如,科學家受到天然DNA分子堿基互補配對原則的啟發(fā),開發(fā)了DNA分子邏輯門計算機,實現(xiàn)了在生物體內(nèi)進行數(shù)字運算[3];利用DNA內(nèi)部相鄰核苷酸間距為3.3Å的特點,實現(xiàn)對于發(fā)色團,熒光基團以及蛋白質(zhì)等距離的精確控制[4];受到天然DNA的連接化學啟示而開發(fā)出的DNA固相合成技術(shù),實現(xiàn)了對于DNA這種大分子聚合物聚合度的精確控制[5]。近年來,利用DNA的精確性和可編程性特點,人們開始拓展DNA工程在生物醫(yī)學方面的應用,如設計DNA納米機器人用于可編程的藥物輸送[6];制造基于DNA的分子疫苗,通過控制抗原間距和尺寸以達到最大的B細胞反應[7];及利用DNA折紙對距離的精確控制實現(xiàn)脂質(zhì)轉(zhuǎn)移[8]。然而,到目前為止,尚未揭示DNA是否可以作為雙價配體分子之間的連接子來精細調(diào)節(jié)配體-受體的識別構(gòu)象。
肖澤宇教授和張健教授團隊等近期合作發(fā)表的Chem率先闡明了DNA為藥物或探針分子設計帶來的新啟示。在該項工作中,研究團隊另辟蹊徑的關注到了DNA作為雙價配體分子中連接子的潛力,并用于開發(fā)“正構(gòu)-變構(gòu)“共同作用的雙價配體分子庫中。雙價配體包含兩個藥效團,并需要通過連接子偶聯(lián)構(gòu)成一個分子。不同長度及化學組成的連接子會對整個雙價配體分子的性質(zhì)產(chǎn)生影響。傳統(tǒng)方法利用聚合物做連接子難以實現(xiàn)精細調(diào)節(jié),且主要依賴分步液相合成方法實現(xiàn)雙價配體的構(gòu)筑,然而不同長短和結(jié)構(gòu)組成的連接子偶聯(lián)涉及較為繁瑣的過程。該項工作開發(fā)了雙價配體的“DNA模塊化”構(gòu)筑策略,利用DNA的結(jié)構(gòu)單元脫氧核苷酸作為連接子,巧妙地解決了這一問題。通過將正構(gòu)和變構(gòu)藥效團分別修飾成為用于固相合成的原料模塊,即可借助DNA自動合成技術(shù),構(gòu)建一系列具有精確差異的藥效團空間距離和空間取向的雙價配體分子;此外,DNA模塊化策略極大簡化了雙價配體分子合成的步驟,便于高效構(gòu)筑雙價配體候選分子庫。
更獨特的是,該策略實現(xiàn)了雙價配體對受體識別在單脫氧核苷酸水平的調(diào)控。增減脫氧核苷酸數(shù)目,即可在埃到納米尺度調(diào)控兩個藥效團之間的空間距離;更換脫氧核苷酸的堿基類型即可精細調(diào)節(jié)藥效團的空間取向,從而真正實現(xiàn)了對藥效團間距及空間取向的精細調(diào)控。
此研究充分體現(xiàn)了化學、生物、藥學、工程的學科交叉,是DNA在藥物或探針分子設計領域、尤其是雙識別位點分子設計領域的開拓性工作,揭示了DNA作為藥效團之間連接子,精細調(diào)控藥物與靶點(或配體與受體)識別構(gòu)象的全新可能及獨特優(yōu)勢,為研發(fā)新型雙價配體探針或雙價藥物分子提供了全新視角及構(gòu)筑策略。該方法與傳統(tǒng)方法相比,無論是在結(jié)構(gòu)功能調(diào)控的精準性,還是在雙價分子合成的簡便性都有巨大的提升,充分展示出DNA結(jié)構(gòu)精確可控的特點及作為連接子的強大優(yōu)勢。總而言之,該研究無論在藥物或探針分子設計領域,還是在DNA納米技術(shù)的生物醫(yī)藥應用領域,都是極具啟發(fā)的開創(chuàng)性工作,有望為雙價配體探針或雙價藥物分子的研發(fā)提供通用型設計平臺,并拓展了DNA作為功能元件在生物醫(yī)藥領域的應用。

