
近日,上海交通大學(xué)基礎(chǔ)醫(yī)學(xué)院方超教授團(tuán)隊(duì)在國際權(quán)威期刊Adv Funct Mater在線發(fā)表了題為“Metal-Coordinated Adsorption of Nanoparticles to Macrophages for Targeted Cancer Therapy”研究論文。該研究創(chuàng)建了一種簡易、高效的胞外粘附納米粒的巨噬細(xì)胞遞藥系統(tǒng),為基于活細(xì)胞的高效遞藥系統(tǒng)的研發(fā)提供了新的平臺技術(shù)。研究工作將作為Front Cover論文正式發(fā)表。

近年來,基于活細(xì)胞的藥物遞送系統(tǒng)吸引了國內(nèi)外研究者的極大興趣和高度關(guān)注。與人工合成的藥物載體相比,活細(xì)胞具有更好的生物相容性和安全性,巨噬細(xì)胞、中性粒細(xì)胞、T細(xì)胞、NK細(xì)胞等免疫細(xì)胞還能響應(yīng)病灶部位釋放的信號分子,實(shí)現(xiàn)靶向藥物遞送和治療。目前,活細(xì)胞遞送系統(tǒng)的發(fā)展仍受到藥物和載體細(xì)胞相互不利影響的限制。如何在不影響載體細(xì)胞功能的情況下荷載藥物是活細(xì)胞遞送系統(tǒng)面臨的主要挑戰(zhàn)。利用免疫細(xì)胞的吞噬作用攝取載藥納米粒是常見的載藥方法。然而,藥物在細(xì)胞內(nèi)提前釋放會影響載體細(xì)胞的活性和趨化能力。此外,載體細(xì)胞通常也難以將細(xì)胞內(nèi)的藥物釋放出來,有時甚至?xí)谌苊阁w等細(xì)胞器中將藥物滅活,限制療效。相比而言,將載藥納米粒附著在細(xì)胞的表面,既可減少對載體細(xì)胞的損傷,也便于藥物在病灶部位的高效釋放。現(xiàn)有的用于胞外載藥的化學(xué)鍵合、物理粘附或者配體-受體識別的方法常涉及較為復(fù)雜的化學(xué)和工程學(xué)操作,亟需開發(fā)簡易、高效的細(xì)胞外載藥新技術(shù)。
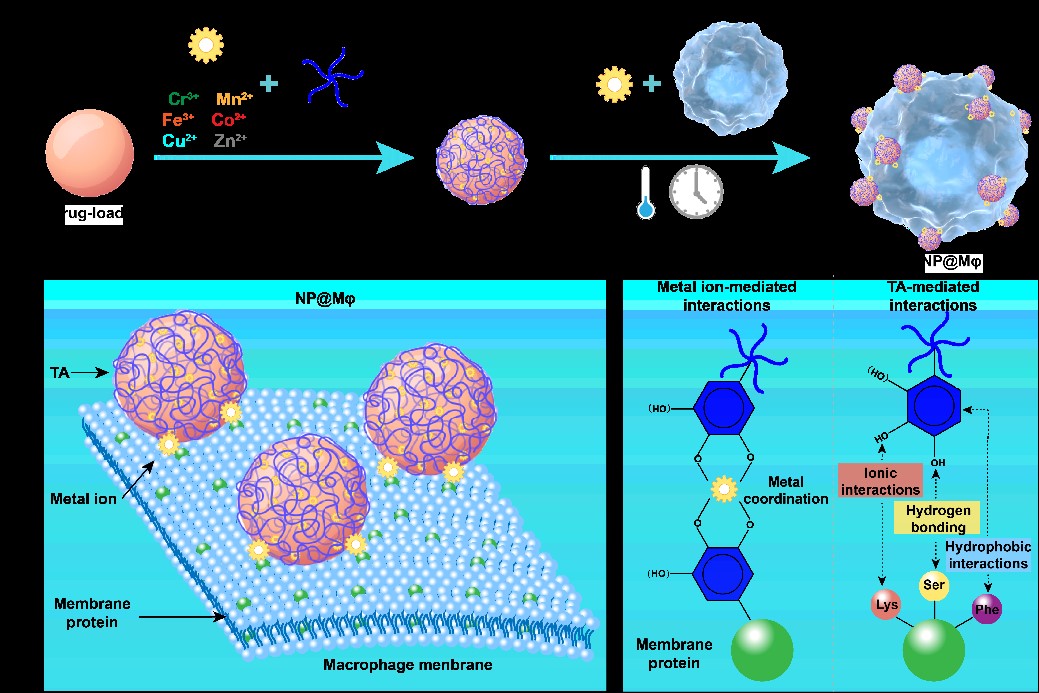
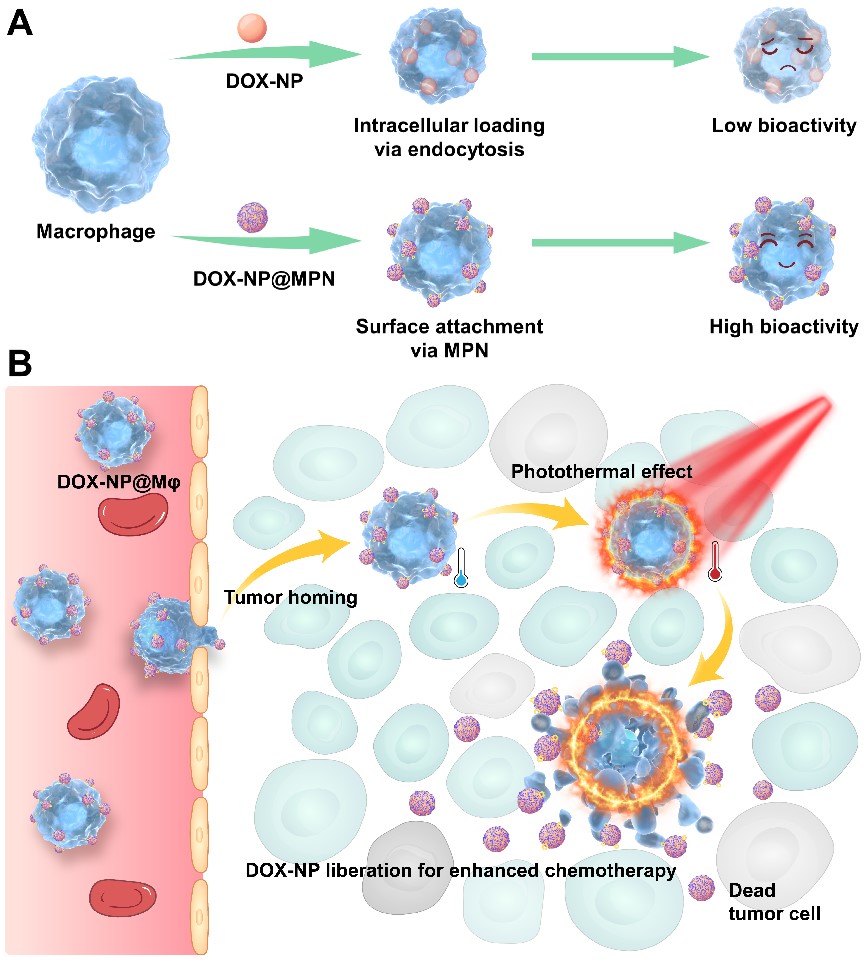
研究團(tuán)隊(duì)創(chuàng)新性地利用二價金屬離子(Cu2+、Mn2+、Co2+、Zn2+等)與多酚(單寧酸)的配位作用建立了一種基于巨噬細(xì)胞(Mφ)的胞外附著阿霉素納米粒(DOX-NP)的活細(xì)胞遞送系統(tǒng)(DOX-NP@Mφ)。根據(jù)熒光信號統(tǒng)計(jì),超過90%的活細(xì)胞相關(guān)的納米粒子被吸附在胞外。該方法很好地保持了巨噬細(xì)胞的活性和腫瘤靶向趨化性,進(jìn)一步利用鐵離子(Fe3+)-多酚網(wǎng)絡(luò)的光熱作用觸發(fā)DOX-NP從載體細(xì)胞上解離,增強(qiáng)抗腫瘤療效。該方法簡易、高效,冰浴條件下2分鐘即可實(shí)現(xiàn)胞外載藥的遞藥系統(tǒng)搭建,這一技術(shù)亦可用于靈活“訂制”滿足其他疾病治療需求的基于活細(xì)胞載體的藥物遞送系統(tǒng)。
上海交通大學(xué)醫(yī)學(xué)院博士生朱茂華、碩士生朱欣迪(現(xiàn)上海第九人民醫(yī)院臨床藥師)為本論文的共同第一作者,方超教授為該論文的通訊作者。上海中醫(yī)藥大學(xué)陳紅專教授、美國University at Buffalo(SUNY)Jonathan F. Lovell教授給予了重要支持和幫助。研究工作得到國家自然科學(xué)基金、上海市科委、上海市衛(wèi)生健康委的資助。

