近日,鐘清團(tuán)隊與曹木青團(tuán)隊合作,在Nature Communications上發(fā)表研究論文:An Actin Filament Branching Surveillance System Regulates Cell Cycle Progression, Cytokinesis and Primary Ciliogenesis。研究發(fā)現(xiàn)中心體作為重要的信號傳導(dǎo)中心通過監(jiān)測中心體周圍的微絲骨架網(wǎng)絡(luò)調(diào)控細(xì)胞周期。微絲骨架茂盛則細(xì)胞分裂,反之稀疏的微絲骨架阻滯細(xì)胞周期。研究揭示了中心體蛋白OFD1 (Oral-Facial-Digital syndrome 1, OFD1),作為微絲II型成核促進(jìn)因子(Nucleation Promoting Factors, NPFs),協(xié)同Arp2/3復(fù)合物調(diào)控中心體周圍的微絲分支動態(tài)變化;同時發(fā)現(xiàn),微絲分支動態(tài)性的改變導(dǎo)致OFD1通過“液-凝膠”相轉(zhuǎn)變的形式失活并降解。去除OFD1或破壞OFD1-Arp2/3復(fù)合體的相互作用,激活RB通路促使增殖的非轉(zhuǎn)化細(xì)胞退出細(xì)胞分裂周期進(jìn)入靜息狀態(tài)(G0期),同時誘導(dǎo)細(xì)胞組裝纖毛;在原癌基因誘導(dǎo)的轉(zhuǎn)化細(xì)胞和大部分腫瘤細(xì)胞中去除OFD1,細(xì)胞雖可跨越上述細(xì)胞周期阻滯,但最終無法有效形成胞質(zhì)分裂環(huán),而發(fā)生不可逆的細(xì)胞死亡。研究揭示了中心體微絲骨架的細(xì)胞功能和調(diào)控機(jī)制,為腫瘤的治療提供了新的思路和潛在靶點。

中心體是動物細(xì)胞主要的微管組織中心,調(diào)控細(xì)胞分裂和纖毛發(fā)生等關(guān)鍵細(xì)胞過程。近期研究發(fā)現(xiàn),中心體周圍存在高度動態(tài)的微絲骨架(Actin filaments)網(wǎng)絡(luò),而且中心體外圍組分參與中心體周圍微絲骨架網(wǎng)絡(luò)的組裝。作為細(xì)胞重要的骨架成分,微絲形成高度動態(tài)的分支骨架網(wǎng)絡(luò),通過快速組裝與解聚,響應(yīng)局部的生理或病理信號,調(diào)控細(xì)胞多項生命活動1-4。然而,中心體微絲的動態(tài)性如何被調(diào)控,以及中心體微絲網(wǎng)絡(luò)動態(tài)調(diào)控所參與的細(xì)胞生理過程還不清楚。
鐘清團(tuán)隊長期聚焦自噬的生化調(diào)控與功能研究,探索自噬與腫瘤等人類重大疾病的關(guān)系,開發(fā)疾病治療的技術(shù)方法。曹木青團(tuán)隊多年來致力于纖毛的結(jié)構(gòu)與功能研究,探索纖毛病的發(fā)病機(jī)制。團(tuán)隊的合作實現(xiàn)了優(yōu)勢互補(bǔ),本研究通過使用體外生化重建與細(xì)胞超分辨熒光成像等技術(shù)發(fā)現(xiàn):一方面,纖毛病相關(guān)蛋白OFD1可作為II型成核促進(jìn)因子,其C末端存在一個保守的酸性A結(jié)構(gòu)域(Acidic domain),用于結(jié)合激活A(yù)rp2/3復(fù)合物(actin-related protein 2/3 complex),并協(xié)同I型NFPs促進(jìn)中心體微絲骨架網(wǎng)絡(luò)的分支動態(tài)調(diào)控;另一方面,OFD1能夠感知中心體微絲骨架網(wǎng)絡(luò)的擾動,當(dāng)骨架網(wǎng)絡(luò)分支受到干擾,定位于中心體微衛(wèi)星處的OFD1會從“液—液”相分離狀態(tài)轉(zhuǎn)變?yōu)椤耙骸z”狀態(tài)失活或降解。
細(xì)胞周期調(diào)控失常和原纖毛缺失是多種腫瘤的特征5, 6,二者的調(diào)控是否相關(guān),何種驅(qū)動機(jī)制調(diào)控了上述現(xiàn)象,尚不清晰。敲降OFD1或干擾OFD1與Arp2/3復(fù)合體的結(jié)合,正常細(xì)胞RPE1進(jìn)入可逆的G0細(xì)胞周期阻滯,并伴隨著纖毛的形成;恢復(fù)OFD1表達(dá)后,纖毛去組裝,細(xì)胞重新進(jìn)入分裂周期開始增殖。出乎意料的是,OFD1敲降造成的細(xì)胞周期阻滯,并不依賴于原纖毛的形成或中心體缺陷激活的USP28-53BP1-p53-p21信號軸起作用。RNASeq分析發(fā)現(xiàn),上述周期阻滯伴隨著RB通路的激活。SV40 T Antigen編碼基因是來源于病毒的原癌基因,SV40 T Antigen可以同時破壞p53-p21通路和RB-E2F通路,導(dǎo)致正常細(xì)胞發(fā)生惡性轉(zhuǎn)化,具備腫瘤細(xì)胞的特性。在RPE1-SV40 TAg轉(zhuǎn)化的細(xì)胞中,敲降OFD1,可誘導(dǎo)纖毛組裝,細(xì)胞卻不再發(fā)生G0細(xì)胞周期阻滯。值得注意的是,敲降OFD1后,細(xì)胞雖然跨越了G0細(xì)胞周期的阻滯,細(xì)胞數(shù)目卻無法增長。追溯其原因,發(fā)現(xiàn)敲降OFD1后大部分細(xì)胞出現(xiàn)了明顯多倍體現(xiàn)象,說明DNA可以完成復(fù)制,但胞質(zhì)分裂出現(xiàn)紊亂。活細(xì)胞成像技術(shù)的應(yīng)用進(jìn)一步發(fā)現(xiàn),OFD1除了定位于中心體與中心體微衛(wèi)星周圍,也分布在胞質(zhì)分裂環(huán)附近,OFD1丟失導(dǎo)致胞質(zhì)分裂環(huán)附近的微絲骨架變得疏松,表現(xiàn)出胞質(zhì)分裂的缺陷和細(xì)胞分裂死亡。同樣的,大部分的腫瘤細(xì)胞也表現(xiàn)出類似特點,敲降OFD1或干擾OFD1與Arp2/3復(fù)合物的結(jié)合,造成腫瘤細(xì)胞發(fā)生胞質(zhì)分裂缺陷和細(xì)胞死亡。
通過對TCGA數(shù)據(jù)庫的分析發(fā)現(xiàn),與對應(yīng)的正常組織相比,結(jié)直腸癌、膠質(zhì)母細(xì)胞瘤、腎癌、肝癌、肺癌和前列腺癌等多種腫瘤組織中OFD1的表達(dá)異常增加;使用免疫組化技術(shù),同樣發(fā)現(xiàn)在結(jié)腸腺癌(COAD)和肺癌患者腫瘤組織中OFD1的蛋白水平顯著高于癌旁組織,提示腫瘤細(xì)胞很可能通過提升OFD1的蛋白水平,來維持細(xì)胞高速增殖的狀態(tài),并抑制了原纖毛的形成。在惡性程度較高的胰腺癌、結(jié)腸癌和三陰性乳腺癌的異種移植模型中,靶向OFD1,能顯著抑制腫瘤的發(fā)生發(fā)展。
綜上所述,本研究發(fā)現(xiàn)了OFD1作為II型成核促進(jìn)因子的生化活性,也揭示了OFD1調(diào)控微絲骨架網(wǎng)絡(luò)分支動態(tài)性的方式和微絲網(wǎng)絡(luò)的監(jiān)察機(jī)制,該機(jī)制的激活決定了正常細(xì)胞和腫瘤細(xì)胞不同的命運,靶向該監(jiān)察機(jī)制,有望為腫瘤的治療提供新策略。
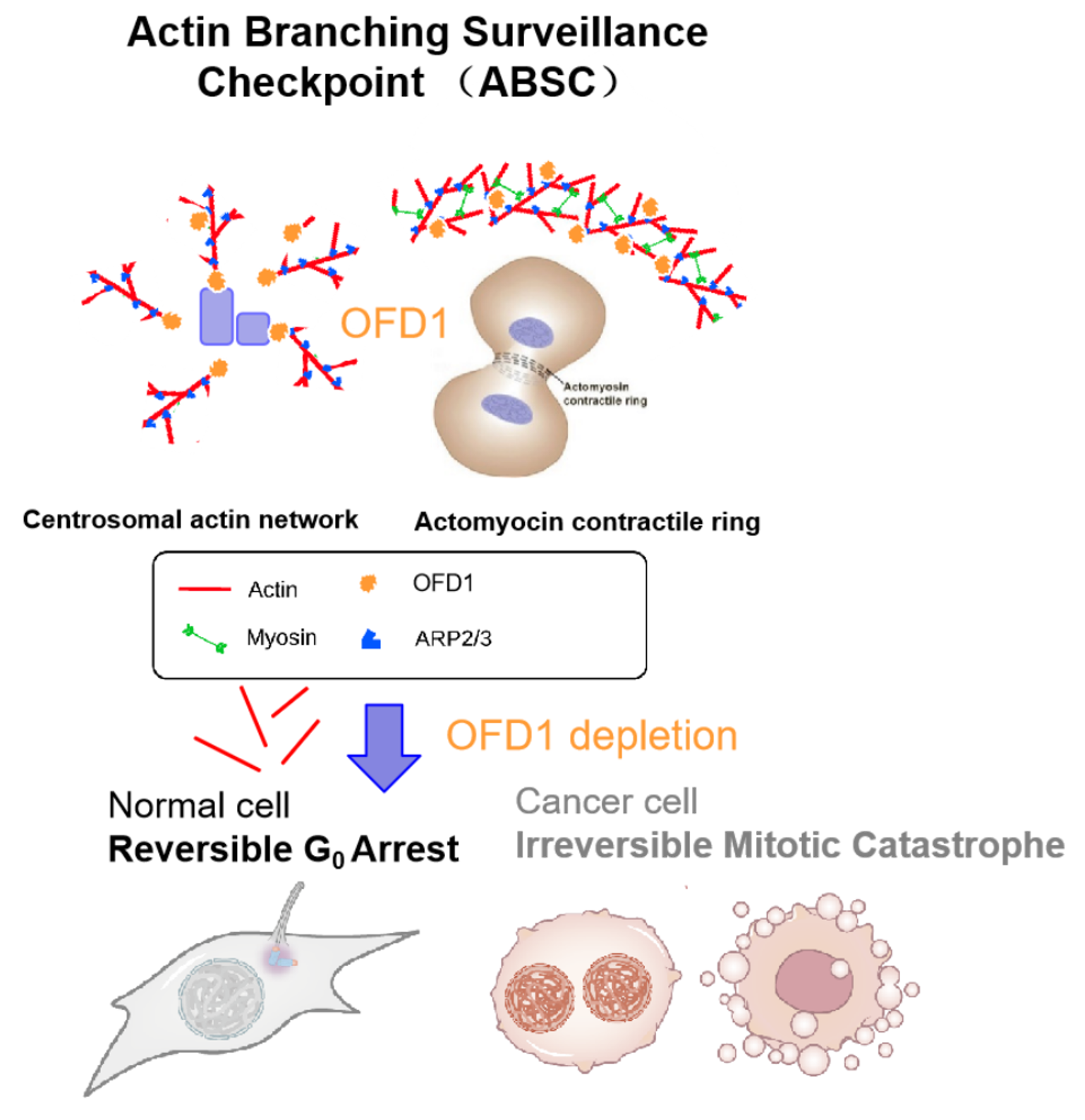
“OFD1介導(dǎo)的中心體微絲網(wǎng)絡(luò)監(jiān)察機(jī)制”調(diào)控模式圖
曹木青、鄒肖肖和李超怡為論文的共同第一作者,曹木青、湯在明和鐘清為論文的通訊作者,林再勝、汪旎、葉幼瓊以及美國得州大學(xué)西南醫(yī)學(xué)中心的Zhongju Zou、Joachim Seemann、Beth Levine為本文共同作者。清華大學(xué)潘俊敏教授、馬里蘭大學(xué)William Snell教授、美國得州大學(xué)西南醫(yī)學(xué)中心Saikat Mukhopadhyay教授和Rolf Brekken教授,也對本研究給予了極大的支持。本研究得到了國家自然科學(xué)基金項目,國家重點研發(fā)計劃,上海市學(xué)術(shù)帶頭人項目,上海市自然科學(xué)基金、上海高水平地方高校創(chuàng)新團(tuán)隊、上海市前沿基地中心、癌基因及相關(guān)基因國家重點實驗室開放課題等項目資助。

