1月2日,上海交通大學(xué)基礎(chǔ)醫(yī)學(xué)院免疫學(xué)與微生物學(xué)系/上海市免疫學(xué)研究所陳廣潔、王兆軍課題組及合作團(tuán)隊(duì)在國(guó)際期刊Nature Communications在線發(fā)表了題為“Synovial microenvironment-influenced mast cells promote the progression of rheumatoid arthritis”的研究論文。該研究揭示了類風(fēng)濕性關(guān)節(jié)炎患者滑膜肥大細(xì)胞擴(kuò)增和活化的可能機(jī)制,表明疾病微環(huán)境中肥大細(xì)胞自身活化并調(diào)控CD4+T細(xì)胞反應(yīng),共同參與疾病進(jìn)展,提示肥大細(xì)胞靶向療法在類風(fēng)濕性關(guān)節(jié)炎免疫治療中的應(yīng)用前景。

肥大細(xì)胞是廣泛存在于人體多種組織的固有免疫細(xì)胞,胞內(nèi)含有大量預(yù)先合成的顆粒介質(zhì),包括多種蛋白酶和組胺。肥大細(xì)胞在體內(nèi)表現(xiàn)出較大的異質(zhì)性,不同組織中肥大細(xì)胞有不同的受體表達(dá)譜和功能【1】。長(zhǎng)期以來肥大細(xì)胞一直被認(rèn)為是過敏性疾病的重要驅(qū)動(dòng)因素【2】。近期研究表明,肥大細(xì)胞也參與了腫瘤和炎癥性疾病的進(jìn)展【3,4】,然而肥大細(xì)胞在自身免疫性疾病如類風(fēng)濕性關(guān)節(jié)炎(rheumatoid arthritis, RA)中的表型、功能和臨床意義尚不明確。
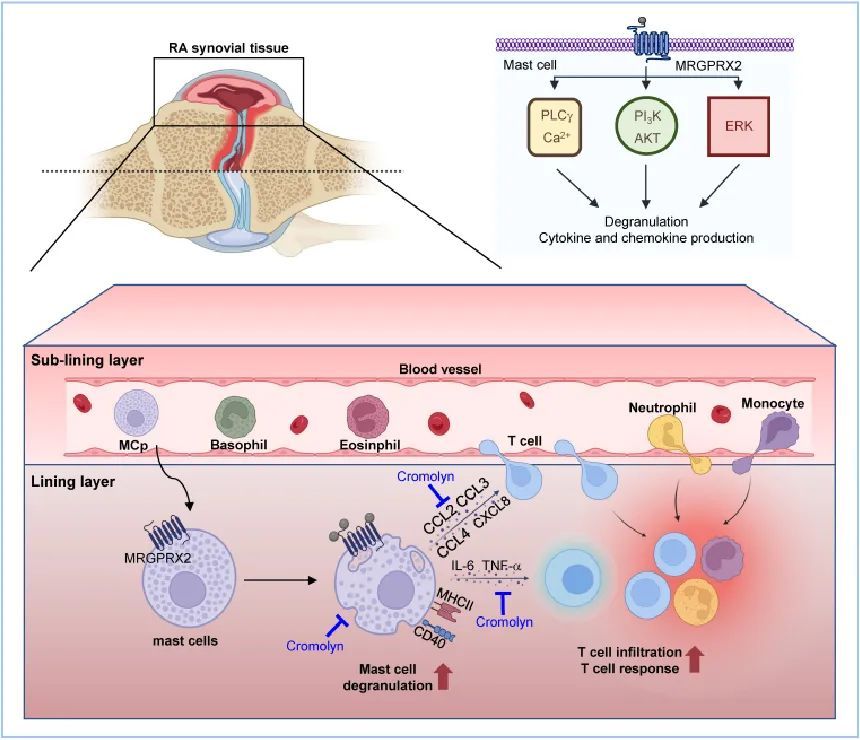
本研究中,研究團(tuán)隊(duì)首先通過檢測(cè)臨床樣本,發(fā)現(xiàn)RA患者的滑膜肥大細(xì)胞顯著擴(kuò)增,并且其數(shù)目與疾病活動(dòng)度指標(biāo)呈正相關(guān),增多的肥大細(xì)胞主要來自于外周循環(huán)肥大細(xì)胞前體的補(bǔ)充。為了進(jìn)一步明確疾病微環(huán)境對(duì)于肥大細(xì)胞表型和功能的塑造,研究者通過蛋白組學(xué)和體外細(xì)胞實(shí)驗(yàn)進(jìn)行分析,結(jié)果顯示RA微環(huán)境中滑膜肥大細(xì)胞的活化由MRGPRX2受體介導(dǎo),并且肥大細(xì)胞表面的MHC Ⅱ類分子和共刺激分子的表達(dá)上調(diào);表型改變的滑膜肥大細(xì)胞可能通過釋放炎性介質(zhì)和直接細(xì)胞接觸促進(jìn)CD4+T細(xì)胞反應(yīng),共同參與疾病的發(fā)生發(fā)展。隨后,研究團(tuán)隊(duì)在小鼠實(shí)驗(yàn)中發(fā)現(xiàn),關(guān)節(jié)炎小鼠過繼轉(zhuǎn)移肥大細(xì)胞后表現(xiàn)出更嚴(yán)重的疾病表型,而使用色苷酸鈉靶向抑制肥大細(xì)胞脫顆粒可以緩解關(guān)節(jié)炎小鼠的病程,與抗IL-17A抗體聯(lián)合使用治療效果更好。綜上,研究團(tuán)隊(duì)提出,肥大細(xì)胞在RA微環(huán)境中可轉(zhuǎn)變?yōu)榛罨拇傺妆硇停瑥亩鴧⑴c了疾病的進(jìn)展;這也為闡明RA的發(fā)病機(jī)制提供了全新的觀點(diǎn),肥大細(xì)胞有望成為RA免疫治療潛在靶點(diǎn)。
基礎(chǔ)醫(yī)學(xué)院免微系/上海市免疫學(xué)研究所博士雷蘊(yùn)軒和郭鑫為本文的共同第一作者,陳廣潔教授、王兆軍教授和附屬第六人民醫(yī)院骨科彭曉春主任醫(yī)師為本文的共同通訊作者。本研究得到了國(guó)家自然科學(xué)基金資助,以及上海市免疫學(xué)研究所流式和成像平臺(tái)、基礎(chǔ)醫(yī)學(xué)院公共技術(shù)平臺(tái)、動(dòng)科部等平臺(tái)的技術(shù)支持。本研究還得到了免疫所蘇冰教授和劉兆遠(yuǎn)副研究員等合作實(shí)驗(yàn)室研究人員的大力支持與幫助。
【參考文獻(xiàn)】
1.Plum, T. et al. Human Mast Cell Proteome Reveals Unique Lineage, Putative Functions, and Structural Basis for Cell Ablation. Immunity 52, 404-416.e5 (2020).
2. Galli, S. J., Gaudenzio, N. & Tsai, M. Mast Cells in Inflammation and Disease: Recent Progress and Ongoing Concerns. Annu Rev Immunol 38, 49–77 (2020).
3. Green, D. P., Limjunyawong, N., Gour, N., Pundir, P. & Dong, X. A Mast-Cell-Specific Receptor Mediates Neurogenic Inflammation and Pain. Neuron 101, 412 (2019).
4. Lv, Y. et al. Increased intratumoral mast cells foster immune suppression and gastric cancer progression through TNF-α-PD-L1 pathway. J Immunother Cancer 7, 54 (2019).

