
2月27日,上海交通大學基礎醫(yī)學院、上海市免疫學研究所鄒強研究團隊等在Immunity雜志在線發(fā)表了題為“Lactate modulates RNA splicing to promote CTLA-4 expression in tumor-infiltrating regulatory T cells”的研究論文。該研究發(fā)現(xiàn)代謝產(chǎn)物乳酸通過促進腫瘤浸潤Treg細胞中CTLA-4的RNA剪接及其表達從而維持Treg細胞免疫抑制功能的作用機制,闡述了乳酸-Foxp3-USP39-CTLA-4信號軸介導腫瘤浸潤Treg細胞高表達CTLA-4的分子機制,提示腫瘤免疫治療的新方向即靶向Treg細胞RNA剪接以增強抗腫瘤免疫治療的應用前景。
免疫檢查點阻斷療法(ICB)在腫瘤治療中取得巨大進展。其中,CTLA-4作為經(jīng)典的免疫檢查點,通過多種機制負調(diào)控T細胞活性1。靶向CTLA-4的單克隆抗體作為第一個獲批上市的免疫檢查點抑制劑藥物,在臨床腫瘤治療中得到廣泛應用。CTLA-4單抗不僅激活效應T細胞,也能通過結合FcgR清除腫瘤浸潤Treg細胞2,3。然而,臨床上也存在部分腫瘤患者無法響應CTLA-4單抗治療,且CTLA-4單抗治療帶來的免疫相關副反應(irAEs)給腫瘤患者帶來巨大痛苦。已有的研究表明,腫瘤細胞利用無氧糖酵解產(chǎn)生的乳酸在腫瘤微環(huán)境中發(fā)揮重要的免疫調(diào)節(jié)作用。乳酸能夠增強腫瘤浸潤Treg細胞的免疫抑制活性,包括通過調(diào)控Treg細胞中PD-1的表達影響PD-1單抗治療腫瘤療效4,5。CTLA-4作為Treg細胞中另一個重要的免疫檢查點,乳酸是否調(diào)控CTLA-4表達水平進而影響CTLA-4單抗療效的機制亟待揭示。
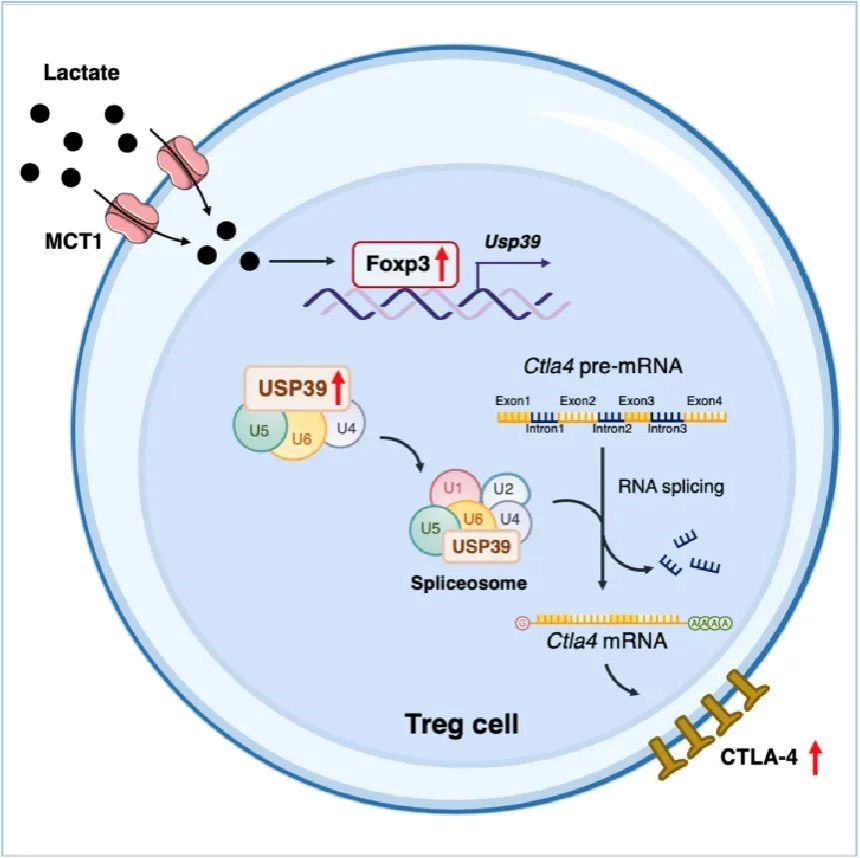
研究團隊結合大數(shù)據(jù)分析和多種小鼠腫瘤模型發(fā)現(xiàn),Treg細胞中乳酸轉(zhuǎn)運受體MCT1特異性缺失的荷瘤小鼠無法響應CTLA-4單抗治療。進一步實驗結果表明,腫瘤浸潤Treg細胞通過乳酸轉(zhuǎn)運受體MCT1攝取乳酸,促進Foxp3的表達;Foxp3作為Treg細胞中關鍵的轉(zhuǎn)錄因子,促進剪接體關鍵組分USP39的轉(zhuǎn)錄及表達。USP39對于mRNA前體(pre-mRNA)剪接和成熟至關重要,研究人員通過轉(zhuǎn)錄組測序分析發(fā)現(xiàn)USP39特異性調(diào)控Ctla4 pre-mRNA的剪接,進而促進Treg細胞中CTLA-4的表達,從而影響CTLA-4單抗療效。同時,研究團隊分析結直腸癌患者外周Treg細胞和腫瘤浸潤Treg細胞發(fā)現(xiàn),USP39的表達和CTLA4 pre-mRNA剪接效率在Treg細胞浸潤至腫瘤微環(huán)境后被顯著上調(diào)。綜上,該項研究闡明了腫瘤浸潤Treg細胞中“乳酸-Foxp3-USP39-CTLA-4”信號軸介導CTLA-4高表達的分子機制,揭示了代謝產(chǎn)物乳酸影響ICB療效的作用機制,提示了靶向Treg細胞RNA剪接以增強抗腫瘤免疫治療的的治療潛力和臨床應用前景。
上海交通大學基礎醫(yī)學院、上海市免疫學研究所博士生丁睿、副研究員于曉彥和南京醫(yī)科大學基礎醫(yī)學院胡志林教授為文章的共同第一作者。上海交通大學基礎醫(yī)學院、上海市免疫學研究所鄒強研究員、葉幼瓊研究員、上海交通大學醫(yī)學院附屬瑞金醫(yī)院趙任教授和河北工程大學倪志宇教授為文章的通訊作者。本研究得到了國家自然科學基金杰青、重點項目等資助,以及上海市免疫學研究所流式平臺、動科部等平臺的技術支持。
參考文獻
1.Van Coillie, S.; Wiernicki, B.; Xu, J., Molecular and Cellular Functions of CTLA-4. Adv Exp Med Biol 2020, 1248, 7-32.
2.Leach, D. R.; Krummel, M. F.; Allison, J. P., Enhancement of antitumor immunity by CTLA-4 blockade. Science 1996, 271 (5256), 1734-6.
3.Simpson, T. R.; Li, F.; Montalvo-Ortiz, W.; Sepulveda, M. A.; Bergerhoff, K.; Arce, F.; Roddie, C.; Henry, J. Y.; Yagita, H.; Wolchok, J. D.; Peggs, K. S.; Ravetch, J. V.; Allison, J. P.; Quezada, S. A., Fc-dependent depletion of tumor-infiltrating regulatory T cells co-defines the efficacy of anti-CTLA-4 therapy against melanoma. J Exp Med 2013, 210 (9), 1695-710.
4.Watson, M. J.; Vignali, P. D. A.; Mullett, S. J.; Overacre-Delgoffe, A. E.; Peralta, R. M.; Grebinoski, S.; Menk, A. V.; Rittenhouse, N. L.; DePeaux, K.; Whetstone, R. D.; Vignali, D. A. A.; Hand, T. W.; Poholek, A. C.; Morrison, B. M.; Rothstein, J. D.; Wendell, S. G.; Delgoffe, G. M., Metabolic support of tumour-infiltrating regulatory T cells by lactic acid. Nature 2021, 591 (7851), 645-651.
5.Kumagai, S.; Koyama, S.; Itahashi, K.; Tanegashima, T.; Lin, Y. T.; Togashi, Y.; Kamada, T.; Irie, T.; Okumura, G.; Kono, H.; Ito, D.; Fujii, R.; Watanabe, S.; Sai, A.; Fukuoka, S.; Sugiyama, E.; Watanabe, G.; Owari, T.; Nishinakamura, H.; Sugiyama, D.; Maeda, Y.; Kawazoe, A.; Yukami, H.; Chida, K.; Ohara, Y.; Yoshida, T.; Shinno, Y.; Takeyasu, Y.; Shirasawa, M.; Nakama, K.; Aokage, K.; Suzuki, J.; Ishii, G.; Kuwata, T.; Sakamoto, N.; Kawazu, M.; Ueno, T.; Mori, T.; Yamazaki, N.; Tsuboi, M.; Yatabe, Y.; Kinoshita, T.; Doi, T.; Shitara, K.; Mano, H.; Nishikawa, H., Lactic acid promotes PD-1 expression in regulatory T cells in highly glycolytic tumor microenvironments. Cancer Cell 2022, 40 (2), 201-218.e9.

