
近日,藥理學(xué)與化學(xué)生物學(xué)系高小玲教授在國際權(quán)威雜志《先進材料》(Advanced Materials)正式發(fā)表了題為“Brain delivery of protein therapeutics by cell matrix-inspired biomimetic nanocarrier”的研究論文。該研究基于仿生學(xué)原理,模擬蛋白質(zhì)天然存在環(huán)境和天然納米載體體內(nèi)轉(zhuǎn)運機制,采用仿生的類細胞基質(zhì)核心和重組高密度脂蛋白(reconstituted High. Density Lipoprotein,rHDL)分別模擬細胞基質(zhì)和高密度脂蛋白(High Density Lipoprotein,HDL)結(jié)構(gòu),構(gòu)建仿生蛋白質(zhì)治療藥物載體實現(xiàn)腦內(nèi)遞送和生物學(xué)效應(yīng)的發(fā)揮。
蛋白質(zhì)藥物已成為醫(yī)藥領(lǐng)域最受關(guān)注的焦點,連續(xù)多年占據(jù)全球前十暢銷藥榜首。然而,蛋白質(zhì)的三維結(jié)構(gòu)脆弱,半衰期短,分子量大和親水特性等使其難以高效跨越血腦屏障(Blood-Brain Barrier,BBB)和細胞膜,極大限制了蛋白質(zhì)藥物在中樞神經(jīng)系統(tǒng)疾病治療中的潛在應(yīng)用前景。探索有效安全可控的蛋白質(zhì)治療藥物腦內(nèi)遞送載體具有十分重要科學(xué)意義和應(yīng)用轉(zhuǎn)化價值。
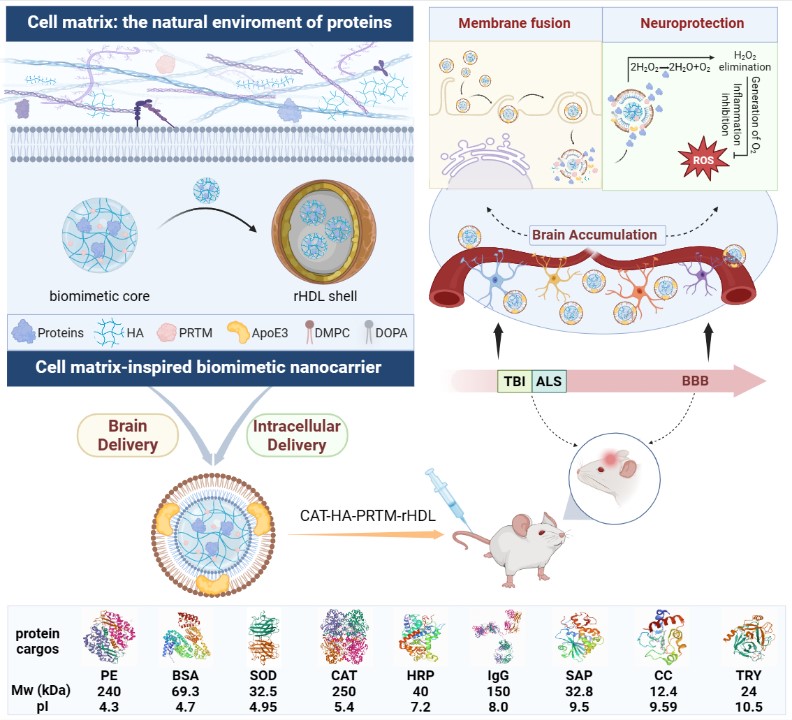
該研究采用細胞基質(zhì)組分透明質(zhì)酸和魚精蛋白,與蛋白質(zhì)通過電荷作用自組裝形成載蛋白質(zhì)的仿生核心,透明質(zhì)酸和魚精蛋白兩者相反的帶電性質(zhì)可平衡蛋白質(zhì)藥物等電點差異,使載體的載藥性能不受蛋白質(zhì)理化性質(zhì)限制,具備載帶蛋白質(zhì)藥物的普適性。同時,類細胞基質(zhì)的仿生核心模仿天然蛋白質(zhì)儲存環(huán)境有效保護蛋白質(zhì)的生物活性。進一步采用rHDL包裹載蛋白質(zhì)藥物的仿生核心形成“類細胞基質(zhì)”的仿生納米載體,模擬生物體內(nèi)轉(zhuǎn)運蛋白質(zhì)的囊泡結(jié)構(gòu),實現(xiàn)蛋白質(zhì)藥物的體內(nèi)長循環(huán),并借助rHDL的靶向遞送特性,實現(xiàn)多種不同理化性質(zhì)蛋白質(zhì)的腦內(nèi)靶細胞遞送。
為揭示“類細胞基質(zhì)”的仿生納米載體介導(dǎo)蛋白質(zhì)藥物的細胞轉(zhuǎn)運的機制,研究人員采用溶酶體逃逸實驗發(fā)現(xiàn)仿生納米載體可避開溶酶體直接將過氧化氫酶(Catalase, CAT)轉(zhuǎn)運至小膠質(zhì)細胞質(zhì);內(nèi)吞通路抑制劑實驗發(fā)現(xiàn)巨胞飲通路參與仿生納米載體的細胞攝取;CAT和仿生納米載體在細胞質(zhì)和細胞膜的定位分析、膜融合探針標記實驗和全內(nèi)反射熒光顯微鏡成像結(jié)果均顯示仿生納米載體的細胞攝取過程存在膜融合機制;透射電子顯微鏡觀察發(fā)現(xiàn)部分仿生納米載體與早期巨胞飲體發(fā)生膜融合,介導(dǎo)CAT的胞內(nèi)高效釋放。上述結(jié)果表明,該仿生納米載體通過與細胞膜和巨胞飲體的膜融合機制高效將蛋白質(zhì)轉(zhuǎn)運至細胞內(nèi)發(fā)揮生物學(xué)活性。
進一步通過中樞神經(jīng)系統(tǒng)疾病相關(guān)病理動物模型評價其藥理學(xué)效應(yīng)。研究表明該載CAT功能蛋白的仿生納米制劑能顯著改善控制性皮質(zhì)損傷(Controlled Cortical Impact,CCI)模型小鼠腦內(nèi)細胞病理形態(tài)、減少神經(jīng)元丟失、降低膠質(zhì)細胞增生,促進CCI模型小鼠空間學(xué)習(xí)記憶能力恢復(fù);同時該制劑也能顯著減少肌萎縮側(cè)索硬化癥(Amyotrpnic Lateral Sclerosis,ALS)模型小鼠脊髓神經(jīng)元丟失、改善脊髓組織病理形態(tài)、降低膠質(zhì)細胞增生,改善ALS模型小鼠運動功能并延長其生存期。
上海交通大學(xué)醫(yī)學(xué)院黃佳琳博士、傅玉立同學(xué)為該論文的共同第一作者,高小玲教授為通訊作者,上海中醫(yī)藥大學(xué)曙光醫(yī)院未來健康實驗室陳紅專教授為共同通訊作者。該工作得到了國家自然科學(xué)基金、國家重點研發(fā)計劃、上海市科委、上海市教委項目的資助。

