近日,著名學(xué)術(shù)期刊Advanced Materials在線發(fā)表了上海交通大學(xué)公共衛(wèi)生學(xué)院宋海云研究員、季曉媛副研究員和上海師范大學(xué)化學(xué)與材料科學(xué)院陳楠教授團(tuán)隊(duì)題為“Dismantlable Coronated Nanoparticles for Coupling the Induction and Perception of Immunogenic Cell Death”的研究成果。該研究設(shè)計(jì)和構(gòu)建了一種可拆分的、具有核-殼結(jié)構(gòu)的抗體冠化納米粒子,在腫瘤微環(huán)境中通過核-殼分離,分別作用于腫瘤細(xì)胞內(nèi)部和腫瘤相關(guān)樹突狀細(xì)胞表面,將免疫原性細(xì)胞死亡信號(hào)的產(chǎn)生與免疫感應(yīng)偶聯(lián),協(xié)同觸發(fā)先天性和適應(yīng)性免疫,進(jìn)一步增強(qiáng)腫瘤對(duì)免疫檢查點(diǎn)療法的敏感性,為腫瘤的化學(xué)與免疫聯(lián)合療法提供了一種新方案。
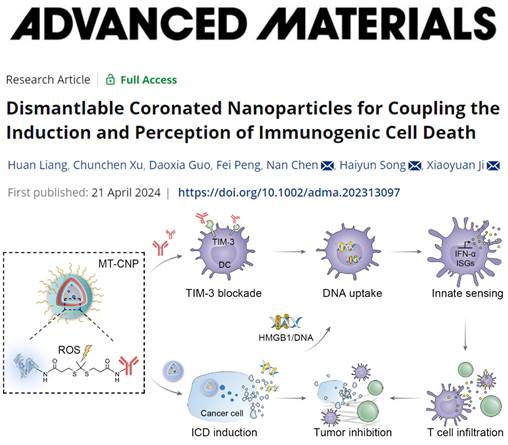
圖1 可拆分抗體冠化納米粒子介導(dǎo)的癌癥聯(lián)合治療策略示意圖。
圖片來源:Adv. Mater.
免疫原性細(xì)胞死亡(ICD)在腫瘤免疫治療中扮演著不可或缺的角色:腫瘤細(xì)胞受到外界壓力刺激發(fā)生死亡時(shí)產(chǎn)生并釋放多種免疫信號(hào)分子,這些信號(hào)分子能夠被樹突狀細(xì)胞(DCs)感知進(jìn)而激活機(jī)體免疫反應(yīng)。然而,DCs表面高表達(dá)的T細(xì)胞免疫球蛋白和粘蛋白結(jié)構(gòu)域-3(TIM-3)將ICD信號(hào)隔離在DC細(xì)胞表面,嚴(yán)重妨礙了DCs對(duì)ICD的感知。研究人員利用裝載ICD誘導(dǎo)劑米托蒽醌(MTO)的介孔硅納米粒子作為抗體冠化納米粒子的內(nèi)核,腫瘤微環(huán)境響應(yīng)性交聯(lián)劑交聯(lián)的TIM-3抗體(αTIM-3)構(gòu)成抗體冠化納米粒子的可拆解外殼,并進(jìn)一步偶聯(lián)腫瘤新生血管靶向肽賦予抗體冠化納米粒子靶向腫瘤組織的能力。在腫瘤微環(huán)境中高水平活性氧的刺激下,該納米粒子的冠狀結(jié)構(gòu)解體,釋放載帶了ICD誘導(dǎo)劑的介孔硅納米粒子和αTIM-3分子。其中,載帶ICD誘導(dǎo)劑的納米粒子內(nèi)核能夠被腫瘤細(xì)胞內(nèi)化,增強(qiáng)ICD,并釋放多種ICD信號(hào)分子;釋放的游離αTIM-3分子阻斷DCs表面的TIM-3,增強(qiáng)其對(duì)ICD信號(hào)分子的感知能力,促進(jìn)DCs成熟,激活T細(xì)胞免疫反應(yīng),協(xié)同抑制腫瘤生長(zhǎng)(圖1)。
在三陰性乳腺癌和結(jié)直腸癌小鼠模型中,包被腫瘤新生血管靶向肽的納米粒子能夠更有效地富集于腫瘤部位,通過同時(shí)增強(qiáng)腫瘤細(xì)胞內(nèi)ICD和阻斷DC表面TIM-3,協(xié)同觸發(fā)先天性和適應(yīng)性免疫以抑制腫瘤的發(fā)展進(jìn)程。此外,研究發(fā)現(xiàn)抗體冠化納米粒子可增強(qiáng)小鼠三陰性乳腺癌和結(jié)直腸癌對(duì)aPD-1的藥物敏感性并顯著延長(zhǎng)小鼠生存時(shí)間。這項(xiàng)研究提出了一種借助可拆分抗體冠化納米粒子實(shí)現(xiàn)腫瘤細(xì)胞殺傷作用與免疫感應(yīng)緊密偶聯(lián)的策略,為腫瘤聯(lián)合療法提供了一種新思路和方法。
上海交通大學(xué)公共衛(wèi)生學(xué)院宋海云研究員、季曉媛副研究員和上海師范大學(xué)化學(xué)與材料科學(xué)院陳楠教授為該文的共同通訊作者。上海交通大學(xué)碩士研究生梁歡、徐春辰和博士研究生郭道霞為該論文的并列第一作者。

