表觀遺傳藥物可直接殺傷腫瘤細(xì)胞,同時啟動先天和適應(yīng)性抗腫瘤免疫反應(yīng),但目前主要應(yīng)用于血液腫瘤的治療,而對于實(shí)體瘤的療效有限,其瓶頸問題在于表觀遺傳藥物會誘導(dǎo)髓源性抑制細(xì)胞(MDSCs)的分化和腫瘤浸潤,所形成的免疫抑制微環(huán)境大大削弱了藥物功效。基于此,上海交通大學(xué)公共衛(wèi)生學(xué)院宋海云研究員團(tuán)隊(duì)和上海師范大學(xué)化學(xué)與材料科學(xué)院陳楠教授團(tuán)隊(duì)設(shè)計(jì)了一種ATP響應(yīng)型連體納米粒子(Siamese nanoparticles, SIANP),可以協(xié)同性地提高腫瘤靶向性和特異性地在腫瘤微環(huán)境中解離,分別向腫瘤細(xì)胞和MDSCs遞送不同的抗腫瘤藥物:利用組蛋白甲基轉(zhuǎn)移酶抑制劑CM-272誘導(dǎo)腫瘤細(xì)胞的免疫原性死亡;利用布魯頓酪氨酸激酶抑制劑Ibrutinib阻遏MDSCs的瘤內(nèi)富集。通過腫瘤微環(huán)境的重塑,抑制腫瘤生長,并進(jìn)一步克服腫瘤對免疫檢查點(diǎn)阻斷治療的耐藥性。該研究發(fā)展了一種精準(zhǔn)、高效的藥物共遞送納米平臺,為增強(qiáng)表觀遺傳療法在實(shí)體腫瘤中的治療功效提供了新思路。相關(guān)工作近期以“Unzippable Siamese Nanoparticles for Programmed Two-Stage Cancer Immunotherapy”為題發(fā)表在高影響力學(xué)術(shù)期刊Advanced Materials。

本研究中,研究人員先分別設(shè)計(jì)了靶向腫瘤細(xì)胞的納米粒子用于負(fù)載CM-272和靶向MDSCs的納米粒子用于負(fù)載Ibrutinib。兩種納米粒子通過表面修飾的DNA單鏈基于堿基互補(bǔ)反應(yīng)進(jìn)行非共價鍵連接。其中一種DNA單鏈中包含了ATP適配體序列,能夠在高濃度ATP的競爭性作用下實(shí)現(xiàn)雙鏈解離。由于腫瘤組織的細(xì)胞外ATP濃度比正常器官的細(xì)胞外ATP濃度高3~4個數(shù)量級,SIANP能夠特異性地在腫瘤微環(huán)境中快速解離成兩種納米粒子,而在血液和正常器官中保持連體狀態(tài)。該設(shè)計(jì)能夠同時借助兩種納米粒子的靶向功能,與共遞送兩種游離藥物或者同時遞送兩種非連體的納米粒子相比,SIANP可達(dá)到更高效、精準(zhǔn)的藥物遞送效率(圖1)。
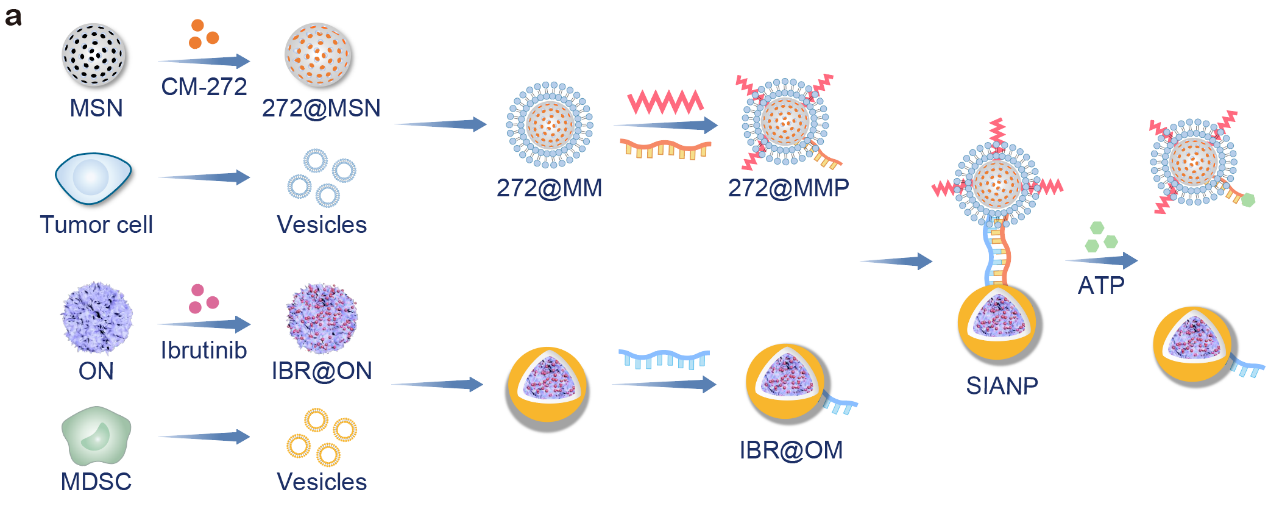
圖1. SIANP的制備過程示意圖。圖片來源:Adv. Mater.
在腫瘤微環(huán)境中,SIANP響應(yīng)ATP解離,分別靶向腫瘤細(xì)胞和MDSCs。進(jìn)入腫瘤細(xì)胞的納米粒子釋放CM-272,通過表觀遺傳調(diào)控誘導(dǎo)內(nèi)源性逆轉(zhuǎn)錄病毒(ERV)表達(dá)和免疫原性細(xì)胞死亡(ICD),激活先天和適應(yīng)性免疫反應(yīng);另一方面,進(jìn)入MDSCs的納米粒子釋放Ibrutinib,通過重編程使MDSCs失去免疫抑制細(xì)胞的特征和功能。在三陰性乳腺癌和結(jié)腸癌小鼠模型中,SIANP可防止CM-272誘導(dǎo)的MDSCs在腫瘤內(nèi)富集,協(xié)同促進(jìn)腫瘤浸潤樹突狀細(xì)胞成熟、CD8+ T細(xì)胞募集和激活,并抑制腫瘤生長(圖2)。此外, SIANP與免疫檢查點(diǎn)抑制劑聯(lián)合治療,能夠克服三陰性乳腺癌對免疫檢查點(diǎn)阻斷療法的耐藥性。
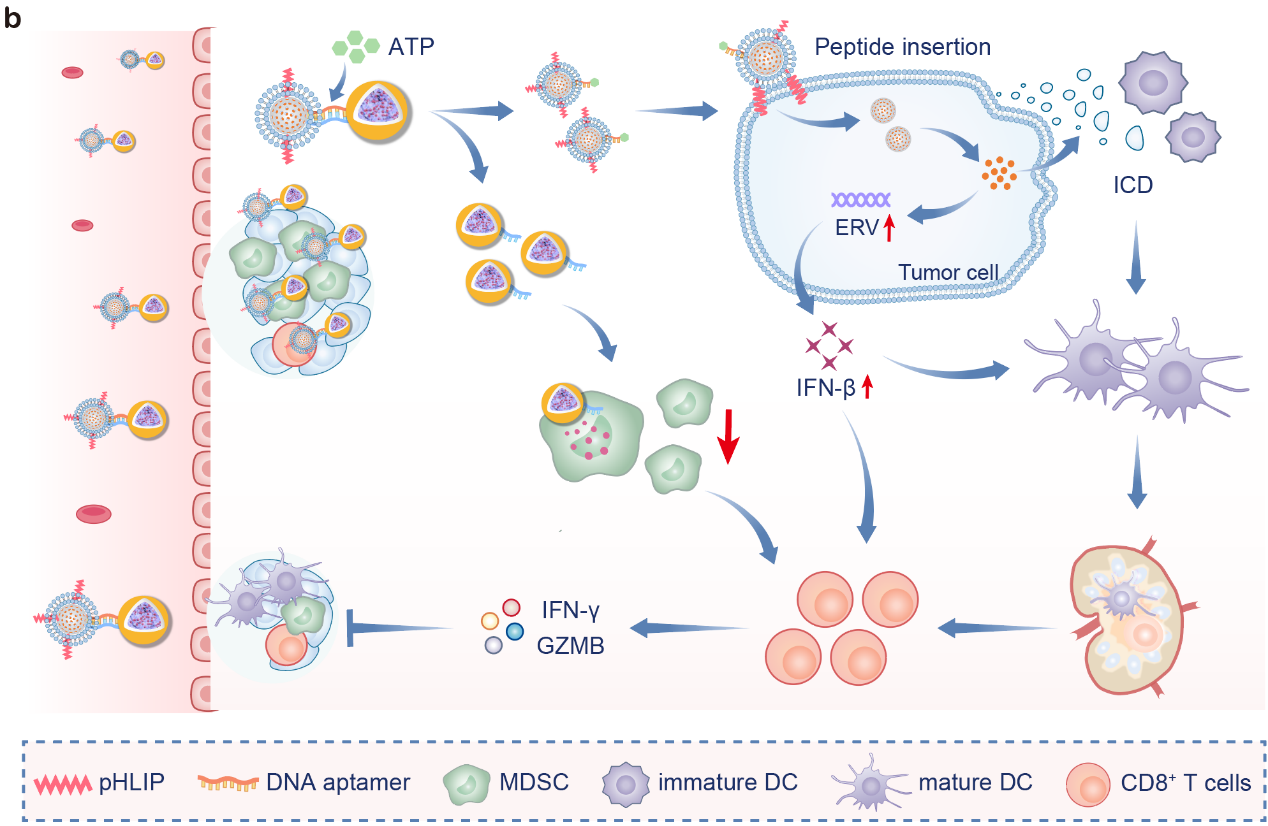
圖2. SIANP的抗腫瘤機(jī)制。圖片來源:Adv. Mater.
上海交通大學(xué)公共衛(wèi)生學(xué)院宋海云研究員和上海師范大學(xué)化學(xué)與材料科學(xué)院陳楠教授為該文的共同通訊作者。上海交通大學(xué)博士研究生隆梅和副研究員周炎烽為該論文的并列第一作者。

