
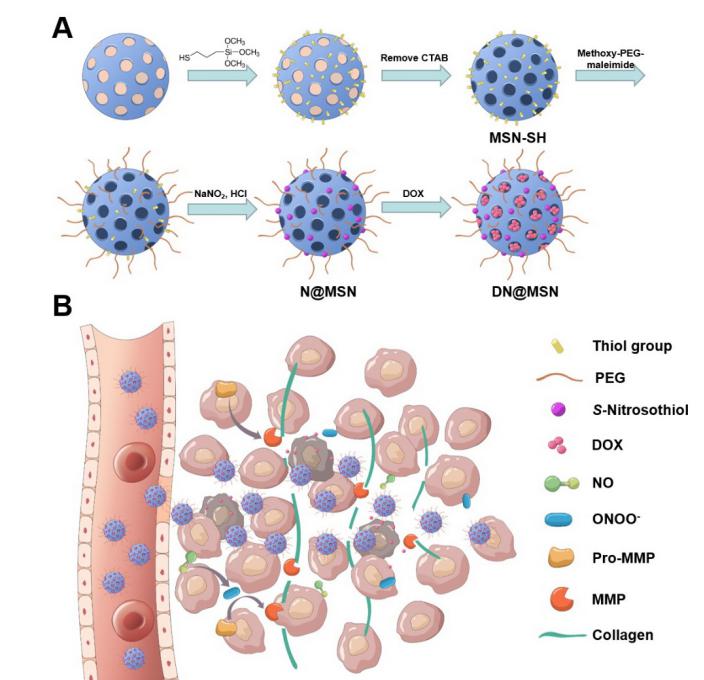
近日,藥理學(xué)與化學(xué)生物學(xué)系方超課題組在美國(guó)化學(xué)會(huì)國(guó)際著名期刊Nano Letters(影響因子為12.08)在線發(fā)表了題為“Enhanced Drug Delivery by Nanoscale Integration of a Nitric Oxide Donor To Induce Tumor Collagen Depletion”的論文。該研究構(gòu)建了基于介孔二氧化硅納米載體的一氧化氮(NO)供體(亞硝基硫醇)與阿霉素靶向共遞送系統(tǒng),該系統(tǒng)可通過(guò)NO對(duì)腫瘤微環(huán)境膠原的降解作用增強(qiáng)納米藥物的腫瘤靶向性和深部滲透。
當(dāng)前,基于納米技術(shù)的腫瘤靶向治療是腫瘤基礎(chǔ)和臨床研究的熱點(diǎn)。FDA已經(jīng)批準(zhǔn)上市了多種抗腫瘤納米藥物(Doxil、Abraxane、Onivyde等),然而這些納米藥物對(duì)患者生存期的延長(zhǎng)作用仍十分有限。研究發(fā)現(xiàn),納米藥物雖可通過(guò)EPR(Enhanced Permeation and Retention)效應(yīng)聚集在腫瘤部位,卻由于腫瘤基質(zhì)(膠原、透明質(zhì)酸等)的阻礙大多數(shù)僅滯留在腫瘤血管周邊,進(jìn)一步向腫瘤深部滲透的作用很弱。因此,表觀的納米藥物腫瘤靶向分布“掩蓋”了深部腫瘤細(xì)胞缺乏有效藥物暴露的微觀困境,導(dǎo)致療效不佳,這也成為限制納米藥物臨床轉(zhuǎn)化的主要瓶頸問(wèn)題。
有研究報(bào)道采用外源性蛋白酶(如菠蘿蛋白酶Bromelain或透明質(zhì)酸酶hyaluronidase)降解腫瘤基質(zhì),促進(jìn)納米藥物腫瘤深部滲透。本研究中,課題組發(fā)明了一種“Protein-free”的基于一氧化氮(NO)的膠原降解新策略。課題組設(shè)計(jì)構(gòu)建了共遞送一氧化氮(NO)供體(亞硝基硫醇S-nitrosothiol)和阿霉素(DOX)的基于介孔二氧化硅的納米系統(tǒng)— DN@MSN。以原位小鼠乳腺腫瘤為模型,DN@MSN靜脈給藥以后,通過(guò)EPR效應(yīng)聚集在腫瘤組織中,亞硝基硫醇分解釋放NO,通過(guò)NO → ONOO-(過(guò)氧亞硝酸鹽)→基質(zhì)金屬蛋白酶(MMP)通路顯著增強(qiáng)腫瘤微環(huán)境MMP-1,-2的表達(dá)量和活性,有效消解(deplete)腫瘤基質(zhì)膠原,促進(jìn)納米藥物腫瘤深部滲透和抗腫瘤療效。另一個(gè)重要發(fā)現(xiàn)在于,NO介導(dǎo)的膠原消解可通過(guò)周細(xì)胞(pericyte)非依賴的方式擴(kuò)張腫瘤內(nèi)部被基質(zhì)擠壓的血管,促進(jìn)納米藥物在腫瘤深部的血流灌注和EPR效應(yīng)。
上海交通大學(xué)基礎(chǔ)醫(yī)學(xué)院博士研究生董霄為該論文的第一作者。上海交通大學(xué)基礎(chǔ)醫(yī)學(xué)院方超教授為該論文的通訊作者。上海交通大學(xué)基礎(chǔ)醫(yī)學(xué)院陳紅專教授和University at Buffalo(State University of New York)的Jonathan F. Lovell教授給予了重要支持。該研究獲得國(guó)家自然科學(xué)基金委、上海市科委和教委項(xiàng)目的資助。該工作也是方超課題組于2017年以來(lái)在國(guó)際著名期刊Adv Funct Mater、Adv Sci、ACS Nano上發(fā)表關(guān)于腫瘤多模式治療“智能”納米系統(tǒng)等多項(xiàng)成果后的又一重要進(jìn)展。
文章鏈接:https://pubs.acs.org.ccindex.cn/doi/10.1021/acs.nanolett.8b04236

