近日,國際知名雜志《美國化學會·催化》(ACS Catalysis,影響因子12.221)在線發(fā)表了基礎醫(yī)學院張健等針對Ras蛋白的題為Deactivation Pathway of Ras GTPase Underlies Conformational Substates as Targets for Drug Design的研究論文,通過揭示Ras蛋白生物催化水解底物失活的動態(tài)過程,闡明了Ras動態(tài)過程中的中間失活構象,基于此發(fā)現(xiàn)了一個全新的隱式變構位點(Hidden Allosteric Site),為后續(xù)靶向Ras蛋白的藥物設計開辟了新的途徑。
Ras是著名的癌基因,它的突變會在超過30%的癌癥中發(fā)生,而突變引起的Ras蛋白的異常激活也和癌癥發(fā)病過程緊密相關。一直以來,人們對于Ras蛋白從激活到失活的轉變的動態(tài)過程了解尚淺,對于Ras蛋白的結構研究也一直乏善可陳,雖然前期已經有多類靶向Ras蛋白的抑制劑被開發(fā),但是最終無一能夠被應用到臨床上針對Ras蛋白介導的癌癥的治療當中,因此,Ras蛋白也一直被認為是不可成藥的(undruggable)。
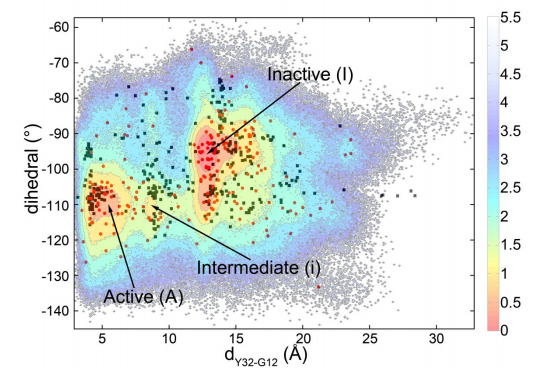
為了進一步探索在Ras蛋白上進行藥物開發(fā)的可能性,此次,研究者決定從它水解失活這一動態(tài)過程入手。利用基于Nudged Elastic Band方法的大規(guī)模分子動力學模擬以及馬爾可夫鏈分析,他們發(fā)現(xiàn)了在Ras水解的通路上存在多個亞狀態(tài)(substates)。

基于這些亞狀態(tài)以及結構分析,研究人員提出了,Ras蛋白的失活過程將會是一個分步過程,即,水解的過程中,首先Ras蛋白中的SW1結構域發(fā)生擺動,與底物GTP之間的相互作用被破壞;隨后進一步SW2結構域再發(fā)生擺動,與底物GTP之間的相互作用受影響。經歷了上述兩個分步的過程后,最終原本結合的GTP會被水解成為GDP,完成蛋白的水解失活過程。
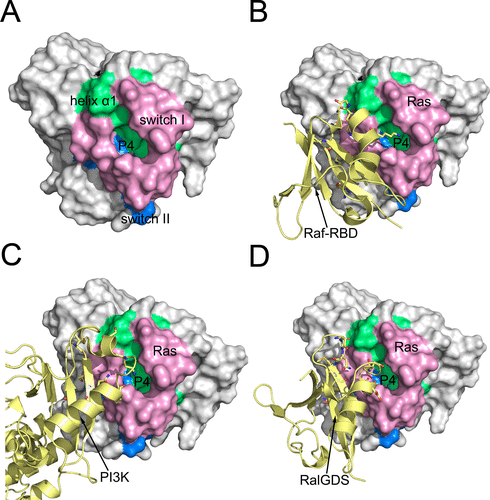
隨后,基于上述所發(fā)現(xiàn)的一系列亞狀態(tài)的結構,研究人員對其進行了隱藏在蛋白內部的變構藥物位點(隱式變構位點)識別,并發(fā)現(xiàn)了一個全新的隱式變構位點P4(T20, I21,Q25, E31, I36, D38, I55)。該位點不僅會對于Ras蛋白自身的GTP酶酶活具有調節(jié)作用,并且還位于Ras蛋白和一系列效應蛋白(effector)相互作用的界面上。而利用突變實驗,進一步闡明了這個位點的變構調節(jié)效應,證實了該位點對于Ras蛋白特異性的變構調節(jié)作用。該位點的發(fā)現(xiàn)將為后續(xù)針對Ras蛋白的變構藥物開發(fā)提供指導,并且也為針對Ras與下游效應蛋白的蛋白相互作用調節(jié)劑的藥物設計提供理論依據。
該研究以Ras蛋白為例,系統(tǒng)提出了在蛋白結構表面無變構位點情況下,如何發(fā)現(xiàn)“隱式變構位點”的方案,不僅為Ras提供了未來藥物研發(fā)的新位點,也為更多此前被認為難成藥靶標的變構藥物設計提供了全新思路和經典案例。本工作第一作者為上海交通大學醫(yī)學院陸紹永副教授、倪端(本科生)和王承祥(博士生),課題受到國家自然基金重大研究計劃、科技部重大項目及重大新藥創(chuàng)制等多個項目的資助。
原文鏈接:https://pubs.acs.org/doi/10.1021/acscatal.9b02556

