10月10日,國際知名學術(shù)期刊《自然-方法(Nature Methods)》在線發(fā)表了中國科學院上海生命科學研究院/上海交通大學醫(yī)學院健康科學研究所常興研究組題為“Targeted AID -mediated mutagenesis (TAM) enablesefficient genomic diversification in mammalian cells”的最新研究成果,報道了利用靶向性胞嘧啶脫氨酶在體內(nèi)實現(xiàn)高效率和高通量的DNA堿基編輯的新方法。
單核苷酸的多樣性是遺傳多樣性的主要來源,是分子進化的動力和很多疾病的直接誘因。然而由于哺乳動物基因組的高度穩(wěn)定性,在哺乳動物細胞內(nèi)很難高效和高通量地誘導單核苷酸的突變,進而研究這些突變的功能。雖然通過CRISPR等基因編輯技術(shù),可以實現(xiàn)較高效的DNA切割和基因敲除,但由于同源重組(HDR)的效率低下,現(xiàn)有的CRISPR技術(shù)對于體內(nèi)構(gòu)建單核苷酸突變?nèi)蕴幱诘托щA段。
靶向性AID介導的核苷酸突變(TAM)這種新的研究方法,有可能改變這一現(xiàn)狀。有別于絕大多數(shù)體細胞基因組,適應性免疫系統(tǒng)在淋巴細胞發(fā)育過程中可以進行高效編輯,對抗原受體進行高效突變,產(chǎn)生近乎無限的抗原受體庫,用以抵御可能的病原體入侵。受這一“突變自我”機制的啟發(fā),博士研究生馬云青和張佳元在常興研究員的指導下發(fā)現(xiàn),當把核酸酶缺陷的Cas9蛋白和誘導抗體高頻突變的胞嘧啶脫氨酶AID融合后,在sgRNA靶向的基因組DNA上,胞嘧啶和鳥嘌呤可以隨機地向其它三個堿基轉(zhuǎn)變。這一新方法可以對細胞內(nèi)的特定DNA序列進行多樣化,完成遺傳篩選,從而分析單核苷酸突變的功能。同時在一種多肽抑制劑的輔助下,dCas9-AID可以誘導特定的胞嘧啶向胸腺嘧啶轉(zhuǎn)變,實現(xiàn)單堿基的精確編輯。該研究團隊進一步證明,利用這一方法可以快速有效地模擬腫瘤細胞體內(nèi)耐藥機制的異質(zhì)性,預測可能的腫瘤耐藥性突變,進而改良小分子抑制劑和研究小分子與蛋白質(zhì)靶點的相互作用。該研究成果為分子進化、基因治療和在單堿基水平上分析基因調(diào)控元件等領(lǐng)域提供新的方法。
該工作得到了科技部、國家自然科學基金委、和上海市科委的相關(guān)資助。
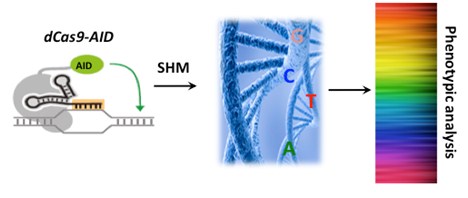
dCas9-AID融合蛋白,被sgRNA招募到相應的基因組DNA上,隨機誘導胞嘧啶和鳥嘌呤的點突變,從而實現(xiàn)體內(nèi)特定DNA序列的多樣化,通過遺傳篩選,高通量分析單核苷酸突變的功能。

