
|
實驗室人員組成: PI(研究員):余健秀 CO-PI(教授):黃建 副研究員:趙嫻 技術(shù)員:王艷麗、陳冉 博士后:張海龍、何建鋒、郭巖珉、李蓮 博士生:劉笑嘉、楊倩倩、黃彩湖、曹瀅婷、黃家怡、陸潤輝 碩士生:方嘉鈺、周子涵、張宇琴、邱麗玲、張雅凡
研究方向:
主要目標(biāo)是通過細(xì)胞系和小鼠動物模型等手段,研究腫瘤發(fā)生和轉(zhuǎn)移的新信號通路分子和細(xì)胞機(jī)制。我們尤其感興趣的是,腫瘤抑制因子及相關(guān)的microRNAs所構(gòu)成的相互調(diào)控網(wǎng)絡(luò)對一些重要的細(xì)胞功能包括細(xì)胞凋亡、腫瘤生長抑制和腫瘤轉(zhuǎn)移抑制的作用機(jī)理。目前我們有以下幾個主要研究方向:
1.腫瘤抑制蛋白修飾與信號傳導(dǎo)
我們以前完成的工作表明,多種腫瘤抑制因子構(gòu)成一個相互調(diào)控并高效抑制腫瘤發(fā)生、生長及轉(zhuǎn)移的調(diào)控網(wǎng)絡(luò),這種網(wǎng)絡(luò)某一環(huán)節(jié)的中斷會加速癌癥發(fā)展進(jìn)程。其中腫瘤抑制蛋白質(zhì)(Egr1、PTEN、p14ARF、p53、p73)的翻譯后修飾直接參與這種調(diào)控網(wǎng)絡(luò)的形成。因此,我們正研究這些腫瘤抑制因子的各種蛋白質(zhì)修飾包括乙酰化、磷酸化、ISG化、SUMO化和泛素化等的作用機(jī)制。
2.MicroRNA調(diào)控炎癥、腫瘤發(fā)生發(fā)展及轉(zhuǎn)移
癌癥是基因組多個基因變異逐漸累積的發(fā)生發(fā)展過程,其特點是無限制增殖、侵襲和轉(zhuǎn)移。在癌癥中,許多分子通路受到影響,涉及到蛋白質(zhì)編碼基因及非編碼基因。而細(xì)胞內(nèi)源性的miRNA網(wǎng)絡(luò)可直接調(diào)控多種基因的表達(dá)。每一個細(xì)胞生理過程均受miRNAs的調(diào)節(jié),而一個異常的miRNAs表達(dá)譜是多種疾病如癌癥等的重要標(biāo)志。眾多的分子生化機(jī)制控制著miRNAs的功能,而miRNAs在惡性腫瘤中尤其顯得重要。在人體內(nèi)一些miRNAs基因充當(dāng)致癌基因,而另一些則是腫瘤抑制基因。miRNAs表達(dá)譜可提供獨(dú)特分析來辨別炎癥及腫瘤的起源,特異miRNAs的過度表達(dá)或表達(dá)不足與臨床腫瘤侵襲或轉(zhuǎn)移相關(guān)聯(lián)。因此,準(zhǔn)確地評價miRNAs表達(dá)變化譜及深入研究miRNA的分子作用機(jī)制,可為深入了解炎癥及癌癥的基本機(jī)制提供新手段、新工具。
3.MicroRNA生物合成的關(guān)鍵蛋白質(zhì)修飾
很多研究發(fā)現(xiàn),腫瘤發(fā)生與某些miRNA表達(dá)異常存在相關(guān)性,在大部分腫瘤中,miRNA整體水平普遍下調(diào),這暗示miRNA生物合成障礙可能是癌癥發(fā)生的一個重要原因。目前認(rèn)為miRNA生物合成障礙主要與miRNA的轉(zhuǎn)錄后調(diào)節(jié)失控、在啟動子區(qū)CpG島甲基化引起的轉(zhuǎn)錄沉默、致癌基因?qū)iRNA轉(zhuǎn)錄抑制等有關(guān)。而另一種可能的調(diào)控機(jī)制是miRNA合成途徑中的RNA修飾和蛋白質(zhì)修飾,以及加工復(fù)合體中其它蛋白的參與。
miRNA基因由RNA聚合酶II或III的轉(zhuǎn)錄成初始miRNAs(Primary miRNAs, pri-miRNA),初始miRNAs經(jīng)由RNA聚合酶IIIDrosha及其輔助因子DGCR8組成的核微加工復(fù)合體(Nuclear microprocessor complex)進(jìn)一步剪切生成發(fā)夾結(jié)構(gòu)的前體miRNA(Precursor miRNA, pre-miRNA)。Pre-miRNAs運(yùn)輸?shù)郊?xì)胞質(zhì)中,再經(jīng)RNA聚合酶Dicer剪切掉miRNA發(fā)夾結(jié)構(gòu)的環(huán),從而產(chǎn)生約20-25個核苷酸的短雙鏈RNA。TRBP2是Dicer的一個結(jié)合蛋白,具有協(xié)同作用。隨后雙鏈RNA中間體解開,單鏈成熟miRNA整合到沉默效應(yīng)復(fù)合體miRNPs中。AGO (Argonaute)是一類小分子RNA結(jié)合蛋白,構(gòu)成基因沉默效應(yīng)復(fù)合體的核心。
課題組在以往工作基礎(chǔ)和現(xiàn)有專業(yè)技術(shù)特色上,針對一些參與miRNA生物合成有關(guān)的重要蛋白質(zhì)DGCR8、TRBP2和AGO2等進(jìn)行研究。目前,我們發(fā)現(xiàn)了一些重要蛋白質(zhì)化學(xué)修飾發(fā)生在這些蛋白質(zhì)上,直接參與調(diào)控miRNA的生物合成及加工。我們正進(jìn)行其主要生物學(xué)功能及其相關(guān)分子機(jī)制的研究,進(jìn)展良好。
4.腫瘤免疫逃逸
NK細(xì)胞(Natural killer cell)也稱為自然殺傷細(xì)胞,是一種先天免疫性的淋巴細(xì)胞,與T淋巴細(xì)胞和B淋巴細(xì)胞不同,它發(fā)揮免疫殺傷作用并不依賴抗體的存在,也不需要預(yù)先致敏,而是直接識別靶細(xì)胞,如腫瘤細(xì)胞和被病毒感染細(xì)胞等,通過細(xì)胞毒作用和分泌多種細(xì)胞因子來殺傷靶細(xì)胞,因此是人類免疫系統(tǒng)的“第一道防線”,在機(jī)體抗感染和惡性腫瘤免疫監(jiān)控過程中發(fā)揮重要作用,同時也是連接先天免疫與繼發(fā)免疫的重要紐帶。
最近研究表明,miRNA在NK細(xì)胞抗感染和惡性腫瘤免疫監(jiān)視過程中發(fā)揮重要作用。但是,對于具體的分子機(jī)制仍然不太清晰,如IL-2、IL-15和IL-21等細(xì)胞因子處理后miRNA如何調(diào)控NK細(xì)胞的激活?如何提高NK細(xì)胞識別和殺傷靶細(xì)胞的效力?到底有哪些miRNA分子參與?這些miRNA又調(diào)節(jié)了哪些基因?尤其是目前的這些研究大多局限于小鼠NK細(xì)胞的miRNA調(diào)節(jié),那么人類NK細(xì)胞激活的miRNA調(diào)節(jié)又如何呢?這些問題都有待我們?nèi)ブ鹨唤鉀Q。目前,我們利用小分子RNA高通量深度測序的方法,對靜息和激活(IL-2、IL-15和IL-21)的人類NK細(xì)胞進(jìn)行測序,鑒定出在人NK細(xì)胞激活的信號傳導(dǎo)途徑中起關(guān)鍵作用的miRNA分子。
另一方面,我們利用本研究組miRNA慢病毒載體表達(dá)庫轉(zhuǎn)染P69T/M12T兩細(xì)胞株,篩選了大量穩(wěn)定表達(dá)miRNA的細(xì)胞系。然后,進(jìn)行NK細(xì)胞殺傷活性試驗,已發(fā)現(xiàn)一些關(guān)鍵miRNAs,可以明顯改變腫瘤細(xì)胞對NK細(xì)胞的殺傷活性。目前,我們正分析這些miRNA調(diào)節(jié)腫瘤細(xì)胞的膜表面受體信號通路及其分子機(jī)制。
研究進(jìn)展:
1. SUMO化修飾介導(dǎo)PTEN膜結(jié)合控制腫瘤發(fā)生發(fā)展的分子機(jī)制
僅次于p53基因,腫瘤抑制基因PTEN是一種在人類癌癥中最常見易突變的基因。PTEN作為一個非常重要的腫瘤抑制蛋白,能有效拮抗PI3K/AKT信號傳導(dǎo)通路而阻止腫瘤發(fā)生發(fā)展。 PTEN作為一個脂類磷酸酶,能將細(xì)胞膜上的PIP3去磷酸化生成PIP2,進(jìn)而拮抗PI3K介導(dǎo)的細(xì)胞生長、代謝、增殖和存活的信號。由于PTEN這一重要性,一直成為細(xì)胞生物學(xué)、分子生物學(xué)、腫瘤學(xué)等領(lǐng)域的研究熱點,故其功能及作用機(jī)制研究得相對較為清楚。PTEN發(fā)揮其最主要功能(將PIP3轉(zhuǎn)換成PIP2),必須先結(jié)合到細(xì)胞膜上,但細(xì)胞體內(nèi)PTEN主要分布在細(xì)胞漿和細(xì)胞核內(nèi)。只有某些細(xì)胞系在特定條件下被觀察到PTEN蛋白轉(zhuǎn)運(yùn)到細(xì)胞膜上。因此,困擾科學(xué)家多年的一個科學(xué)問題:即在胞漿內(nèi)的PTEN是如何與定位于細(xì)胞膜內(nèi)側(cè)的底物PIP3發(fā)生相互作用的?
在大部分細(xì)胞中,PTEN活性的丟失會引起PIP3基礎(chǔ)水平的提高,這暗示著在正常情況下PTEN處于一種平衡狀態(tài),能保持PIP3基礎(chǔ)水平相對低。因此,對此現(xiàn)象只有兩種可能的解釋:一是胞漿內(nèi)自由的PTEN能直接結(jié)合到細(xì)胞膜上,但這種解釋與很多現(xiàn)象不符合;另一是存在一個能與細(xì)胞膜相結(jié)合的“小庫”PTEN(遺憾的是,迄今為止還沒有直接的證據(jù))。對于后一種解釋,仍有許多問題懸而未決。有證據(jù)表明,PTEN結(jié)合到細(xì)胞膜上只需幾百毫秒就足于降解幾個PIP3分子成為PIP2。而在正常情況下,只有極少部分PTEN動態(tài)結(jié)合到細(xì)胞膜上,這可能是由于PTEN呈特定的蛋白質(zhì)構(gòu)象,造成其與細(xì)胞膜結(jié)合親和力低。但目前PTEN“膜結(jié)合”作用的精確機(jī)制仍未十分清楚。我們提出一個PTEN 新作用機(jī)制:SUMO1 化修飾直接參與PTEN“膜
結(jié)合”。
我們實驗室建立了一套很成功的SUMO 化修飾鑒定和功能研究的實驗方法體系,因此最近鑒定出PTEN 的一種新型特異修飾,SUMO1 類泛素化(SUMOylation)修飾發(fā)生在K266 and K254兩個位點上(見圖1),這兩個位點定位于PTEN 的C2 結(jié)構(gòu)域。我們的初步結(jié)果表明這種SUMO1修飾對于PTEN 的腫瘤抑制功能是絕對必須的(圖2)。
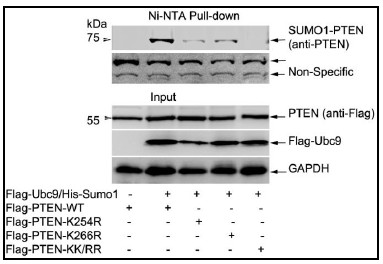
圖1. PTEN 在K
266 和K
254 位點上發(fā)生SUMO1
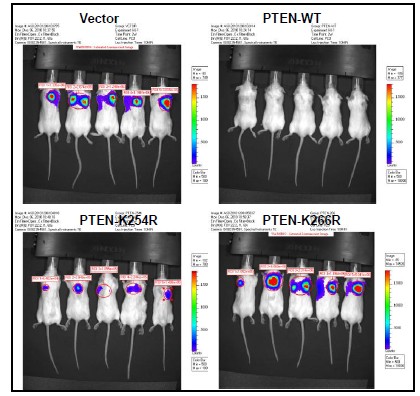
圖2. SUMO1 修飾對于PTEN 的腫瘤抑制功能是絕對必須的
我們實驗研究表明,這種PTEN 的SUMO1 修飾直接參與了PTEN 與細(xì)胞膜內(nèi)側(cè)的底物PIP3的相互作用。利用計算機(jī)分子模擬,將SUMO1 的C -末端甘氨酸羧基與PTEN 的K266 ε-氨基之間形成一個共價異肽鍵。模型分析表明,SUMO1 與PTEN 共同形成帶正電荷的同一界面,可增強(qiáng)與帶負(fù)電荷的磷脂膜相結(jié)合。
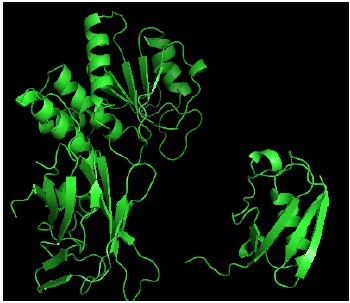
圖3. 計算機(jī)分子模擬一個共價異肽鍵的連接
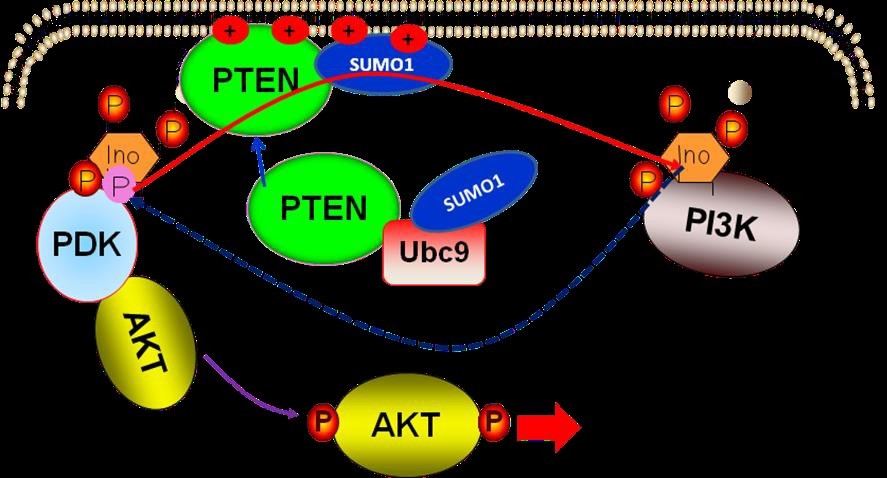
圖4. SUMO 化修飾介導(dǎo)PTEN 膜結(jié)合調(diào)節(jié)PI3K-AKT 信號通路模式圖
我們提出了一個新的PTEN 作用分子機(jī)制:SUMO1 化修飾直接參與PTEN“膜結(jié)合”的快速生化反應(yīng)過程,從本質(zhì)上解釋了PTEN 最重要的作用機(jī)理----即PTEN 如何將PIP3 如何轉(zhuǎn)換成PIP2 的精確分子機(jī)制,回答PTEN 研究中的最為關(guān)鍵的一個科學(xué)問題,即在細(xì)胞質(zhì)胞漿內(nèi)的PTEN是如何與定位于細(xì)胞膜內(nèi)側(cè)的底物PIP3 發(fā)生相互作用 (如圖4)。此項研究已投稿于NATURECOMMUNICATIONS,正修回階段。
另外,關(guān)于蛋白質(zhì)修飾與信號傳導(dǎo),我們還開展了EGR1 蛋白磷酸化修飾、phosphatase類及其相關(guān)蛋白(如PTPN11、 GRB2 等)的SUMO 化修飾等的鑒定與功能研究。
2. MicroRNA調(diào)控炎癥、EMT、腫瘤發(fā)生發(fā)展及轉(zhuǎn)移
自從第一個microRNA,lin-4,于1993年在線蟲發(fā)現(xiàn)以來,得益于克隆和測序技術(shù)的突破,數(shù)量眾多的miRNA被發(fā)現(xiàn)。在人類基因組中,相對于?20,000基因而言,已發(fā)現(xiàn)1576個miRNAs (按2011年11月 miRBase Release 18公布的),估計會多達(dá)2000多個miRNAs基因存在。由約22個核苷酸組成的成熟miRNA,通過DNA甲基化、染色質(zhì)形成、mRNA降解和蛋白質(zhì)翻譯抑制等多種機(jī)制而調(diào)節(jié)基因的表達(dá)。miRNAs與許多重要生物學(xué)功能相聯(lián)系,包括發(fā)育時序、細(xì)胞分化、細(xì)胞增殖、細(xì)胞死亡、代謝調(diào)控、免疫、病毒防御以及轉(zhuǎn)座子沉默等。miRNAs是基因表達(dá)的一種重要調(diào)節(jié)因子。 癌癥是基因組多個基因變異逐漸累積的發(fā)生發(fā)展過程,其特點是無限制增殖、侵襲和轉(zhuǎn)移。在癌癥中,許多分子通路受到影響,涉及到蛋白質(zhì)編碼基因及非編碼基因。而細(xì)胞內(nèi)源性的miRNA網(wǎng)絡(luò)可直接調(diào)控多種基因的表達(dá)。每一個細(xì)胞生理過程均受miRNAs的調(diào)節(jié),而一個異常的miRNAs表達(dá)譜是多種疾病如癌癥等的重要標(biāo)志。眾多的分子生化機(jī)制控制著miRNAs的功能,而miRNAs在惡性腫瘤中尤其顯得重要。在人體內(nèi)一些miRNAs基因充當(dāng)致癌基因,而另一些則是腫瘤抑制基因。miRNAs表達(dá)譜可提供獨(dú)特分析來辨別腫瘤的起源,特異miRNAs的過度表達(dá)或表達(dá)不足與臨床腫瘤侵襲或轉(zhuǎn)移相關(guān)聯(lián)。因此,準(zhǔn)確評價一個miRNAs表達(dá)變化譜可為深入了解癌癥的基本機(jī)制提供新手段、新工具。 前列腺癌(Prostate Cancer, PCa)的發(fā)病率近年來呈迅速上升趨勢。2009年美國前列腺癌占腫瘤新發(fā)病例的19%,死亡率僅次于肺癌,居第二位 [American society of clinical oncology: prostate cancer statistics. http://www.cancer.net/prostate]。全球每年約有30萬以上男性死于前列腺癌。相比于西方國家的發(fā)病率,前列腺癌在亞洲包括我國發(fā)病率相對較低。但隨著人口老齡化及生活條件的改善,發(fā)病率有明顯增加的趨勢。年紀(jì)越大,患前列腺癌的機(jī)率就越高。在我國,隨著飲食結(jié)構(gòu)的改變及老齡化的進(jìn)程,前列腺癌的發(fā)病率從20世紀(jì)60年代的0.48/10萬人上升到2000年的3.7/10萬人。其中,上海地區(qū)前列腺癌發(fā)病率上升最為明顯,由1995年的3.2/10萬人增加到2009年的25/10萬人。患前列腺癌的危險因素包括年齡、家庭歷史、種族和激素狀態(tài)等,此外,有說服力的證據(jù)表明,環(huán)境因素如飲食和生活方式比遺傳易感性來說,在前列腺癌變中發(fā)揮更加重要的作用。因此需要我們對前列腺癌進(jìn)行深入的研究。 本研究組多年從事前列腺癌晚期轉(zhuǎn)移的分子機(jī)理研究,已建立同一人來源的高度轉(zhuǎn)移與不轉(zhuǎn)移的成對細(xì)胞系(M12/P69),經(jīng)前列腺或腹腔注射裸鼠,M12產(chǎn)生肺部轉(zhuǎn)移而P69不會發(fā)生癌細(xì)胞轉(zhuǎn)移。M12細(xì)胞具有明顯EMT轉(zhuǎn)化的特征性標(biāo)記;3D培養(yǎng)技術(shù)分析表明,P69細(xì)胞仍以球狀物生長而M12細(xì)胞則表現(xiàn)為惡性高轉(zhuǎn)移出芽伸展(圖5)。我們對這一對細(xì)胞系進(jìn)行了全miRNAs組的深度測序(deep-sequencing),M12和P69兩細(xì)胞株的小RNA測序均獲得了92%以上的有效讀本,實際值分別達(dá)9698012和11233352。進(jìn)一步分析表明,這對細(xì)胞系的miRNA譜有很大的表達(dá)差異性(圖6): 兩者相同率只為17.13%,M12特異的miRNAs為44.60%, 而P69特異的miRNAs為38.27%。同時,我們還利用新一代高通量測序技術(shù),全面、快速地檢測了P69和M12兩細(xì)胞株的基因表達(dá)情況(圖7)。我們正根據(jù)以上miRNA譜、染色體核型和基因表達(dá)譜三方面的結(jié)果,解析miRNA、靶基因和目標(biāo)蛋白之間的分子調(diào)控網(wǎng)絡(luò)。
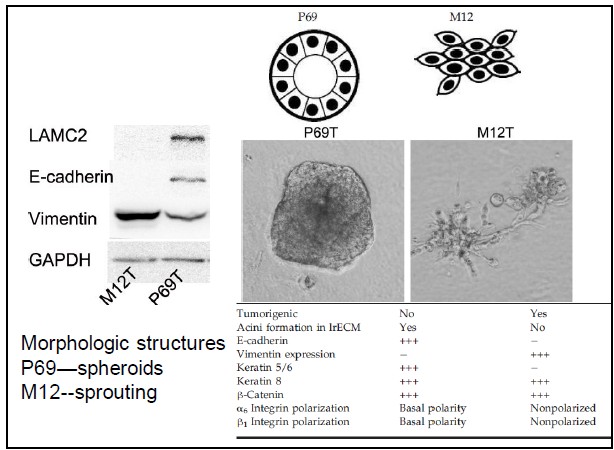
圖5. P69T/M12T 兩個細(xì)胞系在EMT 表型及轉(zhuǎn)移特征的比較(采用3D 培養(yǎng)技術(shù))
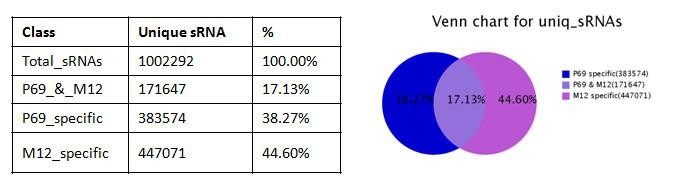
圖6. P69/M12 細(xì)胞系miRNA 深度測序及該對細(xì)胞系的miRNA 譜差異性的比較
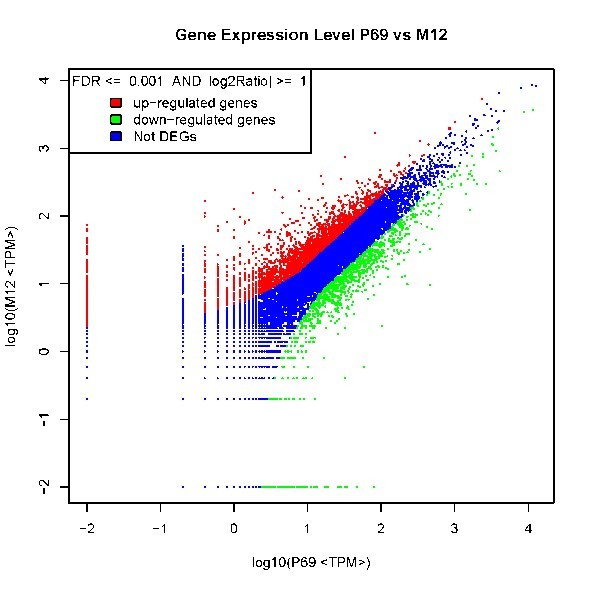
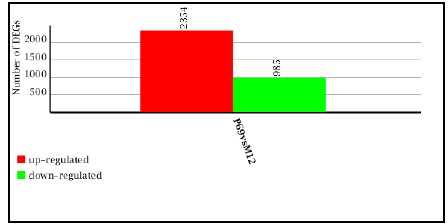
圖7. P69/M12差異表達(dá)基因(Differentially Expressed Genes, DEGs)
我們利用多種技術(shù) (包括Q-PCR, Northblot, EMSA-gel-shift, Luc-reporter, WB, IP, ELISA, 3D-culture and soft-agar, IF, IHC, xCelligence RTCAadhesion/invasion/migration)鑒定了一個關(guān)鍵microRNA-X。這個miR-X具有促進(jìn)多種腫瘤細(xì)胞(如前列腺癌細(xì)胞M12和PC3,及骨肉瘤細(xì)胞LM7等)遷移、侵襲。當(dāng)把此miR-X基因knock-down后,可以完全逆轉(zhuǎn)腫瘤細(xì)胞高轉(zhuǎn)移(如圖8)。此項工作還正在進(jìn)行,我們將進(jìn)一步解析其分子機(jī)制及動物腫瘤模型、臨床標(biāo)本分析,完善此項工作。
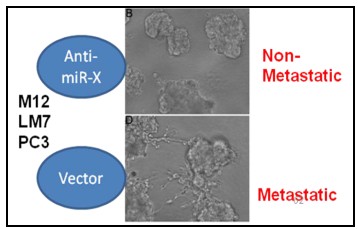
圖8. Anti-miR-X逆轉(zhuǎn)惡性高轉(zhuǎn)移腫瘤細(xì)胞
3. MicroRNA生物合成的關(guān)鍵蛋白質(zhì)修飾
很多研究發(fā)現(xiàn),腫瘤發(fā)生與某些miRNA表達(dá)異常存在相關(guān)性,在大部分腫瘤中,miRNA整體水平普遍下調(diào),這暗示miRNA生物合成障礙可能是癌癥發(fā)生的一個重要原因。目前認(rèn)為miRNA生物合成障礙主要與miRNA的轉(zhuǎn)錄后調(diào)節(jié)失控、在啟動子區(qū)CpG島甲基化引起的轉(zhuǎn)錄沉默、致癌基因?qū)iRNA轉(zhuǎn)錄抑制等有關(guān)。而另一種可能的調(diào)控機(jī)制是miRNA合成途徑中的RNA修飾和蛋白質(zhì)修飾,以及加工復(fù)合體中其它蛋白的參與。 miRNA基因由RNA聚合酶II或III的轉(zhuǎn)錄成初始miRNAs(Primary miRNAs, pri-miRNA),初始miRNAs經(jīng)由RNA聚合酶III Drosha及其輔助因子DGCR8組成的核微加工復(fù)合體(Nuclear microprocessor complex)進(jìn)一步剪切生成發(fā)夾結(jié)構(gòu)的前體miRNA(Precursor miRNA, pre-miRNA)。Pre-miRNAs運(yùn)輸?shù)郊?xì)胞質(zhì)中,再經(jīng)RNA聚合酶Dicer剪切掉miRNA發(fā)夾結(jié)構(gòu)的環(huán),從而產(chǎn)生約20-25個核苷酸的短雙鏈RNA。TRBP2是Dicer的一個結(jié)合蛋白,具有協(xié)同作用。隨后雙鏈RNA中間體解開,單鏈成熟miRNA整合到沉默效應(yīng)復(fù)合體miRNPs中。AGO (Argonaute)是一類小分子RNA結(jié)合蛋白,構(gòu)成基因沉默效應(yīng)復(fù)合體的核心(17-18)。 我們課題組在以往工作基礎(chǔ)和現(xiàn)有專業(yè)技術(shù)特色上,針對一些參與miRNA生物合成有關(guān)的重要蛋白質(zhì)DGCR8、TRBP2和AGO2等進(jìn)行研究。目前,我們發(fā)現(xiàn)了一些重要蛋白質(zhì)化學(xué)修飾發(fā)生在這些蛋白質(zhì)上,直接參與調(diào)控miRNA的生物合成及加工。我們正進(jìn)行其主要生物學(xué)功能及其相關(guān)分子機(jī)制的研究,進(jìn)展良好。
4. 腫瘤免疫逃逸
NK細(xì)胞(Natural killer cell)也稱為自然殺傷細(xì)胞,是一種先天免疫性的淋巴細(xì)胞,與T淋巴細(xì)胞和B淋巴細(xì)胞不同,它發(fā)揮免疫殺傷作用并不依賴抗體的存在,也不需要預(yù)先致敏,而是直接識別靶細(xì)胞,如腫瘤細(xì)胞和被病毒感染細(xì)胞等,通過細(xì)胞毒作用和分泌多種細(xì)胞因子來殺傷靶細(xì)胞,因此是人類免疫系統(tǒng)的“第一道防線”,在機(jī)體抗感染和惡性腫瘤免疫監(jiān)控過程中發(fā)揮重要作用,同時也是連接先天免疫與繼發(fā)免疫的重要紐帶。 最近研究表明,miRNA在NK細(xì)胞抗感染和惡性腫瘤免疫監(jiān)視過程中發(fā)揮重要作用。但是,對于具體的分子機(jī)制仍然不太清晰,如IL-2、IL-15和IL-21等細(xì)胞因子處理后miRNA如何調(diào)控NK細(xì)胞的激活?如何提高NK細(xì)胞識別和殺傷靶細(xì)胞的效力?到底有哪些miRNA分子參與?這些miRNA又調(diào)節(jié)了哪些基因?尤其是目前的這些研究大多局限于小鼠NK細(xì)胞的miRNA調(diào)節(jié),那么人類NK細(xì)胞激活的miRNA調(diào)節(jié)又如何呢?這些問題都有待我們?nèi)ブ鹨唤鉀Q。目前,我們利用小分子RNA高通量深度測序的方法,對靜息和激活(IL-2、IL-15和IL-21)的人類NK細(xì)胞進(jìn)行測序,鑒定出在人NK細(xì)胞激活的信號傳導(dǎo)途徑中起關(guān)鍵作用的miRNA分子,該項研究已投稿。 另一方面,我們利用本研究組miRNA慢病毒載體表達(dá)庫轉(zhuǎn)染P69T/M12T兩細(xì)胞株,篩選了大量穩(wěn)定表達(dá)miRNA的細(xì)胞系。然后,進(jìn)行NK細(xì)胞殺傷活性試驗,已發(fā)現(xiàn)一些關(guān)鍵miRNAs,可以明顯改變腫瘤細(xì)胞對NK細(xì)胞的殺傷活性。目前,我們正分析這些miRNA調(diào)節(jié)腫瘤細(xì)胞的膜表面受體信號通路及其分子機(jī)制。
近期代表性成果簡介:
發(fā)現(xiàn)SUMO化修飾介導(dǎo)PTEN膜結(jié)合控制腫瘤發(fā)生發(fā)展的分子機(jī)制僅次于p53基因,腫瘤抑制基因PTEN是一種在人類癌癥中最常見易突變的基因。PTEN作為一個非常重要的腫瘤抑制蛋白,能有效拮抗PI3K/AKT信號傳導(dǎo)通路而阻止腫瘤發(fā)生發(fā)展。
PTEN作為一個脂類磷酸酶,能將細(xì)胞膜上的PIP3去磷酸化生成PIP2,進(jìn)而拮抗PI3K介導(dǎo)的細(xì)胞生長、代謝、增殖和存活的信號。由于PTEN這一重要性,一直成為細(xì)胞生物學(xué)、分子生物學(xué)、腫瘤學(xué)等領(lǐng)域的研究熱點,故其功能及作用機(jī)制研究得相對較為清楚。PTEN發(fā)揮其最主要功能(將PIP3轉(zhuǎn)換成PIP2),必須先結(jié)合到細(xì)胞膜上,但細(xì)胞體內(nèi)PTEN主要分布在細(xì)胞漿和細(xì)胞核內(nèi)。只有某些細(xì)胞系在特定條件下被觀察到PTEN蛋白轉(zhuǎn)運(yùn)到細(xì)胞膜上。因此,多年來有一個關(guān)鍵科學(xué)問題一直困擾著科學(xué)家:即在胞漿內(nèi)的PTEN是如何與定位于細(xì)胞膜內(nèi)側(cè)的底物PIP3發(fā)生相互作用?
我們最近鑒定出PTEN蛋白一種新型特異修飾,即SUMO1類泛素化(SUMOylation)修飾,發(fā)生在K266 and K254兩個位點上,這兩個位點剛好定位于PTEN的C2結(jié)構(gòu)域。研究結(jié)果表明SUMO1修飾對于PTEN的腫瘤抑制功能是絕對必須的,而且這種修飾直接參與了PTEN與細(xì)胞膜內(nèi)側(cè)的底物PIP3的相互作用。據(jù)此,我們提出了一個新的PTEN作用分子機(jī)制:即SUMO1化修飾直接介導(dǎo)PTEN膜結(jié)合并快速地將PIP3轉(zhuǎn)換成PIP2,進(jìn)而抑制了PI3K-AKT信號通路及腫瘤的發(fā)生發(fā)展(如圖1)。我們的研究回答了PTEN分子作用機(jī)制研究中最為關(guān)鍵的一個科學(xué)問題,即在細(xì)胞質(zhì)胞漿內(nèi)的PTEN是如何與定位于細(xì)胞膜內(nèi)側(cè)的底物PIP3發(fā)生相互作用的分子機(jī)制。相關(guān)論文發(fā)表在Nature Communications(2012),并立即被Faculty of 1000推薦與高度好評 “The data from Huang and co-workers indicate that the lipid phosphatase and tumour suppressor phosphatase andtensin homologue (PTEN) must have a SUMO protein modification in order to access its lipid substrate and inhibitcell proliferation. This may require a reinterpretation of several previous studies of PTEN, but could also shed newlight on the roles in cancer of SUMO-modifying enzymes and SUMO1/sentrin-specific protease 1 (SENP1) inparticular.”。美國Johns Hopkins 大學(xué)Michael J. Matunis 教授為我們的文章專門寫了一篇綜述(Matunis MJ, Guzzo CM, 2012),并作出高度評價“Recent work by Huang and colleagues sheds new light on the mechanisms regulating PTEN association with the plasma membrane (Huang et al., 2012)”
|
