

實(shí)驗(yàn)室成員: PI:李勇 助理研究員:王瑩萍 技術(shù)員:周潔、朱傲雪 研究生:夏變變、翁維吉、鄧琦、張巧、楊洋、向金花、鄺宏鵬、顧曉琨
研究方向及興趣:
研究組以闡述系統(tǒng)相關(guān)的膜受體(尤其是負(fù)責(zé)信息感受和傳導(dǎo)的膜受體與離子通道)的內(nèi)質(zhì)網(wǎng)質(zhì)量控制和膜轉(zhuǎn)運(yùn)過程(包括囊泡蛋白分選、囊泡轉(zhuǎn)運(yùn)、膜和突觸定位及內(nèi)化再循環(huán)過程)調(diào)控的分子機(jī)制及膜受體轉(zhuǎn)運(yùn)與重大神經(jīng)系統(tǒng)疾病發(fā)生發(fā)展的關(guān)系為目標(biāo),致力于揭示重要膜受體轉(zhuǎn)運(yùn)和調(diào)控過程的結(jié)構(gòu)基礎(chǔ)、蛋白相互作用、調(diào)控機(jī)制及其生理學(xué)功能和病理學(xué)意義,探索針對膜受體功能異常的疾病防治策略,對于揭示神經(jīng)信息傳導(dǎo)和突觸可塑性具有重要的理論價(jià)值。
膜受體定位發(fā)生異常可以導(dǎo)致神經(jīng)和精神疾病,因此研究膜受體轉(zhuǎn)運(yùn)機(jī)理有助于發(fā)現(xiàn)新的疾病治療靶點(diǎn)。目前我們研究組主要針對電壓門控鈣離子通道和甘氨酸受體的轉(zhuǎn)運(yùn)調(diào)控,借助基因敲除小鼠(SENP1-/-)和前腦高表達(dá)甘氨酸受體的轉(zhuǎn)基因小鼠,以細(xì)胞生物學(xué)、生物化學(xué)和電生理技術(shù)為主,結(jié)合細(xì)胞和整體動(dòng)物水平功能分析等方法,重點(diǎn)研究:甘氨酸受體轉(zhuǎn)運(yùn)機(jī)制、生理學(xué)功能及與神經(jīng)系統(tǒng)疾病的關(guān)系;電壓門控鈣離子通道的轉(zhuǎn)運(yùn)機(jī)制及其與神經(jīng)信號調(diào)控和突觸可塑性的關(guān)系;神經(jīng)系統(tǒng)重要膜蛋白化學(xué)修飾在神經(jīng)系統(tǒng)中的作用。
研究進(jìn)展:
1.蛋白質(zhì)化學(xué)修飾在神經(jīng)系統(tǒng)中的作用
甘氨酸受體膜轉(zhuǎn)運(yùn)調(diào)節(jié)機(jī)制
神經(jīng)元興奮性是其功能的基礎(chǔ)并受控于突觸興奮和抑制的精細(xì)平衡調(diào)節(jié)。 離子型谷氨酸受體和抑制性氨基酸受體(甘氨酸和GABAA受體)在神經(jīng)元的正確分布、定位和動(dòng)態(tài)調(diào)節(jié)則是其興奮性的生化基礎(chǔ),并直接關(guān)系到神經(jīng)信息的正確處理。神經(jīng)元表面的離子型谷氨酸受體和抑制性氨基酸受體除有組構(gòu)性插入和內(nèi)化,同時(shí)存在重要的神經(jīng)元活動(dòng)依賴性的新增插入或內(nèi)化對總量和亞型組成進(jìn)行調(diào)節(jié),此即構(gòu)成了神經(jīng)元興奮性和突觸效能調(diào)節(jié)的關(guān)鍵環(huán)節(jié)。內(nèi)化的離子型谷氨酸受體和抑制性氨基酸受體根據(jù)神經(jīng)元功能狀態(tài)需求可以通過再循環(huán)重新插入膜表面和突觸,或者進(jìn)入降解途徑。離子型谷氨酸受體和抑制性氨基酸受體的上述膜轉(zhuǎn)運(yùn)過程涉及受體本身膜蛋白的分子內(nèi)部信號和與多種蛋白質(zhì)或蛋白質(zhì)機(jī)器復(fù)雜和精確的相互作用并可能涉及SUMO特異蛋白酶、激酶、磷酸酶和泛素化酶等一系列調(diào)控相關(guān)的蛋白。上述細(xì)胞生物學(xué)過程對于實(shí)現(xiàn)神經(jīng)元興奮性的穩(wěn)態(tài)平衡和信息處理功能具有特殊重要的意義,闡明有關(guān)其細(xì)胞分子機(jī)制的研究已成為神經(jīng)科學(xué)的一個(gè)重要的前沿課題。抑制性突觸活動(dòng)對維持神經(jīng)系統(tǒng)網(wǎng)絡(luò)精確的平衡至關(guān)重要,系統(tǒng)研究在生理內(nèi)環(huán)境下離子型谷氨酸受體和抑制性氨基酸受體膜轉(zhuǎn)運(yùn)、定位及動(dòng)態(tài)調(diào)節(jié)的功能,闡明決定這些蛋白質(zhì)膜轉(zhuǎn)運(yùn)過程的結(jié)構(gòu)基礎(chǔ)、蛋白質(zhì)相互作用及其各種修飾調(diào)控機(jī)制,對于揭示和理解神經(jīng)興奮性的穩(wěn)態(tài)平衡的機(jī)制具有十分重要的理論價(jià)值。也對闡明與此相關(guān)的重要神經(jīng)精神疾病的發(fā)病機(jī)制及新藥靶點(diǎn)的發(fā)現(xiàn)具有潛在的應(yīng)用前景。
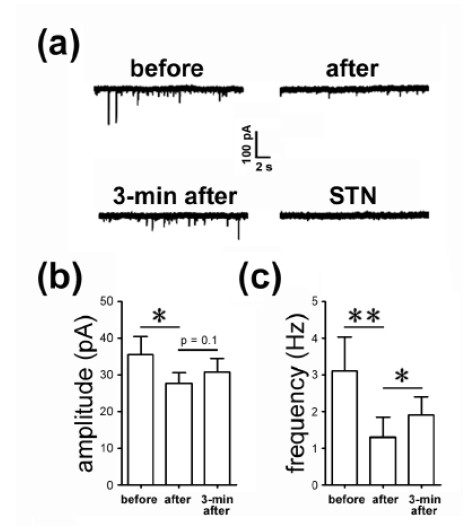

圖1 Kainate 受體的激活引起神經(jīng)元甘氨酸受體的內(nèi)吞
2.電壓依賴離子通道運(yùn)輸?shù)纳飳W(xué)功能和作用機(jī)制研究
14-3-3蛋白調(diào)控N型鈣離子通道(CaV2.2)膜轉(zhuǎn)運(yùn)及其機(jī)制
電壓依賴性鈣離子通道作為傳遞鈣離子的重要門戶,在神經(jīng)系統(tǒng)精密復(fù)雜的病理生理過程中發(fā)揮著關(guān)鍵性的作用,N型電壓依賴性鈣離子通道(CaV2.2),它對于短暫重復(fù)的去極化刺激表現(xiàn)出累積性失活特點(diǎn),這一特性在突觸傳遞的精確性和短時(shí)程突觸可塑性中起著重要的作用。迄今為止,已發(fā)現(xiàn)許多蛋白可以結(jié)合并調(diào)控CaV2.2,其中14-3-3蛋白是一類高度保守的、所有真核生物細(xì)胞中都普遍存在的、在大多數(shù)生物物種中由一個(gè)基因家族編碼的蛋白調(diào)控家族,參與生命體許多的生理反應(yīng)過程,它能與CaV2.2結(jié)合并調(diào)控其失活動(dòng)力學(xué)特性,但眾所周知鈣通道本身功能特性的調(diào)節(jié)并不是決定通道離子通透量的唯一因素,細(xì)胞膜表面鈣離子通道的數(shù)量是另一個(gè)關(guān)鍵性的環(huán)節(jié),14-3-3蛋白是否參與調(diào)節(jié)及其如何調(diào)控電壓依賴性鈣通道的膜轉(zhuǎn)運(yùn),進(jìn)而參與突觸神經(jīng)遞質(zhì)的釋放和突觸可塑性目前仍不清楚。胞內(nèi)鈣信號在機(jī)體生命活動(dòng)中的重要性,使得更深層次的了解電壓依賴性鈣通道的功能特性及其調(diào)控有非同尋常的意義,因此采用tsA201細(xì)胞和培養(yǎng)的海馬神經(jīng)元,過量表達(dá)14-3-3蛋白的條件下, 研究CaV2.2通道細(xì)胞膜表達(dá)量的變化及其相關(guān)的可能機(jī)制。研究發(fā)現(xiàn)14-3-3能夠促進(jìn)N-電壓依賴性鈣離子通道功能亞單位1B在細(xì)胞膜表面的功能表達(dá),dynamin 1以及clathrin可能參與了CaV2.2膜轉(zhuǎn)運(yùn)的調(diào)控過程。
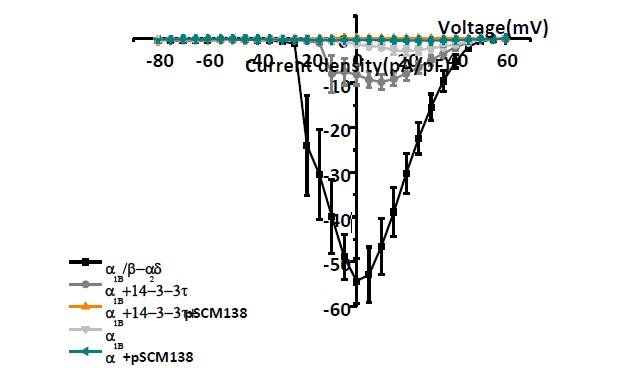
圖2 單獨(dú)轉(zhuǎn)染1B亞基獲得的鈣電流幅度和密度較共轉(zhuǎn)染14-3-3蛋白組小,將pSCM138與1B或與1B、14-3-3共轉(zhuǎn)染,則基本記錄不到電流或僅有很小的鈣電流。
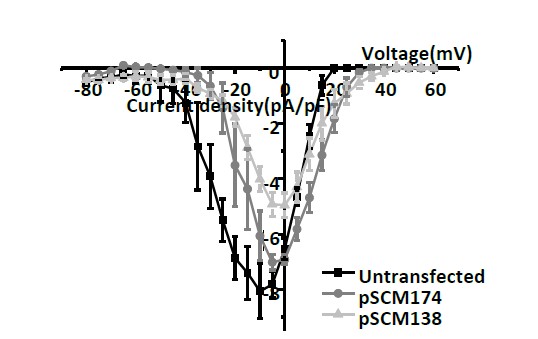
圖3 內(nèi)源性14-3-3蛋白與CaV2.2結(jié)合剝離(共轉(zhuǎn)染pSCM138),使其電流幅度/密度降低,而其突變的pSCM174則幾乎不影響CaV2.2鈣電流幅度/密度。
3.離子型谷氨酸受體的生物學(xué)功能研究
KA受體與14-3-3蛋白的關(guān)系及其對動(dòng)力學(xué)的影響
KA受體(KAR)是離子型谷氨酸受體的一個(gè)亞型,在中樞和外周神經(jīng)系統(tǒng)有著廣泛存在,位于突觸前的KAR可以調(diào)節(jié)抑制性和興奮性神經(jīng)遞質(zhì)的釋放,位于突觸后的KAR可以介導(dǎo)興奮性突觸傳遞,位在突觸外KAR可以調(diào)節(jié)神經(jīng)元的興奮性。在調(diào)節(jié)神經(jīng)突觸可塑性和神經(jīng)網(wǎng)絡(luò)活性起重要作用,并且在病理情況下,像癲癇等疾病的發(fā)生中起重要作用。其中KA受體具有介導(dǎo)的EPSC比NMDA受體、AMPA受體的動(dòng)力學(xué)顯著減慢的特性,我們的研究發(fā)現(xiàn)14-3-3蛋白能夠和GluK2相互結(jié)合,減慢KA受體的脫敏特性,其可能是神經(jīng)元KA受體介導(dǎo)EPSC減慢的原因之一。進(jìn)一步鑒定GluK2與14-3-3蛋白的結(jié)合位點(diǎn)和方式,以及在生理?xiàng)l件下對KA受體介導(dǎo)的EPSC的影響正在進(jìn)展中。
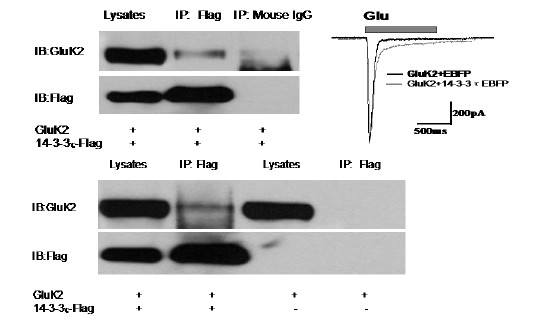
圖4 Co-IP檢測14-3-3蛋白能夠與GluK2結(jié)合,并減慢GluK2同聚體的動(dòng)力學(xué)特性
|